
Collagen으로 유도한 사람 혈소판에서 cyclic nucleotide의 조절로 인한 dioscin의 항혈전 효과
Abstract
The discovery and application of new substances that can regulate and reduce platelet activation are important for the prevention and treatment of cardiovascular diseases. Previous studies have shown that dioscin inhibits the growth of tumor-related cells and induces apoptosis. In addition, although there have been a few reports on the antiplatelet effect of dioscin, there has been no study that elucidated the mechanism of platelet activation using human platelets. Therefore, in this study, we confirmed whether dioscin has an antithrombotic effect by regulating the activation of human platelets. Dioscin increased cAMP and cGMP in human platelets, preventing Ca2+ mobilization by inducing IP3R phosphorylation, and inhibited the binding between integrin αIIb/β3 and fibrinogen by inducing VASP phosphorylation. Finally, dioscin was shown to significantly inhibit thrombin-induced fibrin thrombus formation. Therefore, dioscin has been shown to possess antiplatelet effects that can slow or halt thrombus formation by regulating the phosphorylation of various signaling molecules and related proteins.
Keywords:
Dioscin, Intracellular Ca2+, Cyclic nucleotides, Fibrinogen binding, Thrombus formation혈액은 신체의 장기와 조직으로 영양분과 산소를 제공하고 노폐물을 제거해줌으로써 사람이 생존하는 데 필수적인 역할을 하며, 이 과정이 정상적으로 이루어지기 위하여 원활하게 혈액 순환이 일어나는 것이 중요하다. 피하기 어려운 상황으로 혈관이 손상받게 되었을 때, 혈액 손실을 최소화하면서 정상적인 순환이 일어나게 하기 위한 신체에서의 생리학적 작용으로써 지혈 반응이 촉진되며 혈소판 활성화 과정이 그 시발점이 된다.1) 그러나, 혈소판이 비정상적이거나 과다하게 활성화되는 경우에 뇌경색, 뇌졸중 및 동맥 경화증 등으로 알려져 있는 다양한 혈전성의 질환을 유발하게 된다.2) 이런 이유때문에, 혈소판의 활성화를 조절하면서 혈전 생성을 저해할 수 있는 물질의 발굴 및 개발이 심혈관 질환의 예방 및 치료를 위해 중요하게 여겨지고 있다.
혈관의 손상이 있을 때, 순환하던 혈소판이 병변으로 모여들고 혈소판 활성유도물질(ADP, collagen, arachidonic acid 및 TXA2 등)에 자극을 받아 혈소판의 활성화가 일어난다. 이때, 혈소판 막의 phospholipase C가 활성화되어 인지질 성분으로 알려진 phosphatidylinositol 4,5-bisphosphate를 가수분해함으로써 inositol 1,4,5-triphosphate (IP3)과 diacylglycerol (DG)이 형성된다. 생성이 증가된 IP3는 혈소판 내 dense tubular system에 존재하는 IP3의 수용체인 Ca2+ 채널을 열어주고, 이로 인하여 세포질 내 Ca2+ 농도의 강력한 상승이 일어나게 된다. 3) 또한, 혈소판이 활성화되는과정에서 혈소판 막에 존재하는 인지질이 분해되면서 arachidonic acid의 상승을 유발하는데 이것이 TXA synthase 및 cyclooxygenase-1의 효소반응을 통해 TXA2로 만들어져 혈소판으로부터 분비되어 나온다.4) 혈소판 외부로 방출된 TXA2는 주변의 혈소판들이 가진 TXA2 수용체에 결합됨으로써 추가적인 혈소판 자극 및 활성화를 일으키게 된다.5,6)
정상적으로 혈액 순환이 일어나고 있는 경우라면 혈관 내피세포로부터 prostanglandin I2과 nitric oxide가 분비되면서 혈소판 내의 cAMP 또는 cGMP 생성을 촉진하는데, cAMP 생성 증가에 의해 cAMP 의존성 protein kinase A (PKA)가 활성화 되고 cGMP 생성 증가에 의해 cGMP 의존성 protein kinase G (PKG)가 활성화 된다. 이들 PKA와 PKG는 기질 단백질로서 vasodilator stimulated phosphoprotein (VASP) 또는 IP3 receptor (IP3R)를 인산화를 일으킴으로써 기능한다고 알려져 있다.7) IP3R의 인산화는 세포질로의 Ca2+ 동원의 억제를 유발하고, VASP의 인산화는 αIIb/β3가 활성화되는 것을 막아줌으로써 actin filament가 신장되는 것을 억제하는 것으로 알려져 있다.8-11) 따라서, IP3R 인산화가 기인하는 Ca2+ 동원 억제와 VASP의 인산화를 통해 일어나는 αIIb/β3 활성의 억제가 항혈소판 물질을 평가하는데 있어서 중요한 요소가 된다.
Dioscin은 청미래덩굴(Smilax china)의 뿌리에서 얻은 스테로이드 사포닌의 일종으로, 전립선암 세포, 폐암과 같은 종양 관련 세포 및 골육종 줄기세포에서 주로 MAPK(p38, ERK 및 JNK) 경로를 통해 종양 성장을 억제하고 세포 사멸을 유도한다고 알려져 있다.12-14) 또한 항염증, 지질 저하, 항암, 간 보호 효과 및 암세포 자가포식 유도 등의 효능도 보고된 바 있다. 15) 그러나, 관련 연구들은 대부분 암세포나 면역계 세포들을 이용한 연구들이며, 몇몇 연구에서 dioscin이 항혈소판 효능을 가진다는 보고가 있었으나 사람의 혈소판 세포를 이용하여 dioscin의 항혈소판에 관련한 기전을 살펴본 연구는 아직 보고된 바가 없다.16,17) 따라서, 본 연구에서는 S. china에서 추출한 dioscin의 항혈소판 효과 및 관련 기전을 규명하여 dioscin이 심혈관계 질환을 저해하는 물질로서의 가치가 있는지 확인하고자 하였다.
재료 및 방법
식물 재료 및 시료 준비 - S. china 근경은 한국의 충청북도 충주에서 2023년 10월에 수집하였고, 표본은 국립원예특작과학원으로부터 진위 여부를 확인하였다(보증표본 SC4, No. LEE2023-04). 근경 표본은 채취 후 15일 동안 상대 습도 60~65%, 온도 20~25◦C의 통풍이 가능한 그늘(중앙대학교 식물생명공학과)에서 공기 건조하여 100 g을 확보하였고, 환류 추출기를 사용하여 5시간 동안 에탄올 추출하였다. 생성된 추출물을 여과하고 회전 증발기를 사용하여 농축하여 농축된 에탄올 추출물 5.5 g을 얻었다.
HPLC/ELSD 분석 - HPLC/ELSD 분석은 이전 연구에 설명된 방법에 따라 YMC Pack-Pro C18 컬럼(4.6 × 250 mm, 5 μm)(YMC Co., Kyoto, Japan)이 장착된 역상 HPLC 시스템(Waters Alliance e2695 Separations Module; Waters Co., Milford, MA, USA)을 사용하여 수행하였다.18) Dioscin은 한국 안성의 Natural Product Institute of Science and Technology (www.nist.re.kr)에서 구입하여 사용하였다.
혈소판 현탁액의 준비과정
혈소판의 현탁액 준비 - 사람의 전혈로부터 혈소판 성분만을 분리하여 제조한 농축혈소판 제제를 대한적십자 혈액원의 승인을 거쳐 수원에 위치한 경기혈액원을 통해 확보하였다. 앞선 연구의 방법을 참고하여 농축혈소판 제제를 원심 분리기를 통해 1,650×g에서 8분간 원심하여 혈소판을 모은 후, 138 mM NaCl, 12 mM NaHCO3, 0.36 mM NaH2PO4, 5.5 mM glucose 2.7 mM KCl, 그리고 0.49 mM MgCl2의 조성으로 구성한 현탁 완충액(pH 7.4)에 부유시키는 것을 두 번 반복하여 혈소판을 세척하였고, 최종 농도가 108 cells/mL이 되도록 혈소판 현탁액을 희석하였다.19) 저온의 환경에서 혈소판이 응집되는 것을 막기 위해서 모든 과정이 실온에서 이루어지도록 하였다. 미리 남서울대학교 기관생명윤리 위원회의 승인(1041479-HR-202110-002)을받은 후 연구를 진행하였다.
cyclic nucleotides (cAMP 및 cGMP)의 정량 실험 - 미리 준비된 혈소판 현탁액(108 cells/mL)에 0.05% dimethyl sulfoxide에 다양한 농도로 녹인 dioscin를 첨가하여 3분 동안 37℃에 전처리하였고, 이 후 2 mM CaCl2 및 응집 유도제를 첨가함으로써 응집을 유도하였다. 5분이 지난 후, 반응을 멈추기 위해 같은 양의 100% EtOH를 첨가했고, cAMP 또는 cGMP assay kits (Cayman chemical, Ann Arbor, Michigan, USA)를 통해 cAMP 또는 cGMP 농도를 정량측정하였다.
세포질 내 Ca2+ 동원량 측정 실험 - 농축 혈소판 제제에 Fura 2-AM (5 μM)를 넣어 37℃에서 60분 동안 천천히 섞어주면서 배양하였고, 이 후 위에서 언급한 방법대로 108 cells/mL 농도의 혈소판 현탁액을 준비하였다. 준비된 혈소판 현탁액에 2 mM CaCl2 및 응집 유도제를 첨가함으로써 응집을 유도하였다. 이 때 Fluorescence Spectrophotometer (F7000, Hitachi hightech, Seongnam, Korea)를 사용하여 Fura 2로부터 방출되는 형광을 측정하였다. 여기 파장은 0.5초 간격으로 340 nm에서 380 nm까지 증가하게 하였고, 방출 파장은 510 nm로 고정하여 진행하였다. 측정한 형광 값을 앞선 논문의 산출 방법에 따라 계산하여 Ca2+의 동원량으로 나타내었다.20)
Western blotting를 통한 단백질 확인 실험 - 미리 준비된 혈소판 현탁액(108 cells/mL)에 0.05% dimethyl sulfoxide에 다양한 농도로 녹인 dioscin를 첨가하여 3분 동안 37℃에 전처리하였고, 이 후 2 mM CaCl2 및 응집 유도제를 첨가함으로써 응집을 유도하였다. 반응을 종결하기 위하여 1x lysis buffer를 첨가하였고, 시료 내 존재하는 단백질을 BCA protein assay kit로 정량한 후, 일정한 양(20 μg)을 SDS-PAGE에서 전기영동했다. 분리된 단백질을 PVDF로 옮긴 후, 1차 및 2차 항체에 담구어 항원항체 결합을 유발하였다. 이 후 화학발광 기질을 첨가하여 단백질의 존재 정도에 따라 시각적으로 나타나게 하였으며, 그 결과는 Luminescent Image Analyzer (LAS-4000, Fujifilm, Tokyo, Japan)를 통해 정량화 하였다.
혈소판 막 αIIb/β3에 대한 fibrinogen 결합능 측정 실험 - 미리 준비된 혈소판 현탁액(108 cells/mL)에 0.05% dimethyl sulfoxide에 다양한 농도로 녹인 dioscin를 첨가하여 3분 동안 37℃에 전처리하였고, 이 후 alexa Fluor 488-fibrinogen (20 μg/mL)를 넣어주고, 2 mM CaCl2 및 응집 유도제를 첨가함으로써 응집을 유도하였다. 5분 동안 반응하고 나서 0.5% 파라포름알데하이드가 첨가된 phosphate buffer (pH 7.4)를 같은 양으로 첨가시켜주어 반응을 정지하였고, 모든 과정에서 빛이 차단되도록 알루미늄 호일을 감아주었다. BD Bioscience 사(San Jose, CA, USA)의 FACS장비(유세포 분석기)를 사용하여 fibrinogen이 결합된정도를 측정하였고, 결과 값은 Cell-Quest 소프트웨어(BD Bioscience)를 통해 계산하여 산출하였다.
혈소판 매개의 fibrin clot 측정 실험 - 혈소판이 활성화 되지 않도록 하기 위하여 농축 혈소판 제제를 polyethylene 재질의 시험관으로 옮긴 후, 2 mM CaCl2 및 thrombin (0.05 U/mL)을 첨가하여 37℃에서 20분 동안 정치해 두었다. 시험관에서 fibrin 기반의 clot이 만들어지는 것을 디지털 카메라로 촬영하였고, 이를 ImageJ (v1.46, National Institutes of Health, Bethesda, MD, USA)라는 프로그램을 통해 응고가 일어난 영역만 밀도계산하여 혈전 형성 정도를 확인하였다.
통계 분석 처리 - 수행된 모든 실험 결과는 평균±표준편차로 나타내었고, Student's t-test 또는 ANOVA로 통계분석 하였으며, 분산분석의 결과에서 집단 평균 간에 유의한 차이가 있는 경우, Scheffe의 방법을 사용하여 추가적으로 유의성을 분석하였다. 본 연구의 결과로 통계분석하였을 때, p<0.05로 실험 그룹 간의 차이가 있는 경우, 통계적으로 유의성이 있는 것으로 나타내었다.
결과 및 고찰
HPLC/ELSD 분석을 통한 S. china 근경의 dioscin 함량 - Dioscin의 순도는 99%이다(Fig. 1A). HPLC/ELSD 크로마토그램에서 dioscin의 확인 시간은 40.3분이고, 농도는 추출물 g당 1.67 mg으로 측정되었다(Fig. 1B).
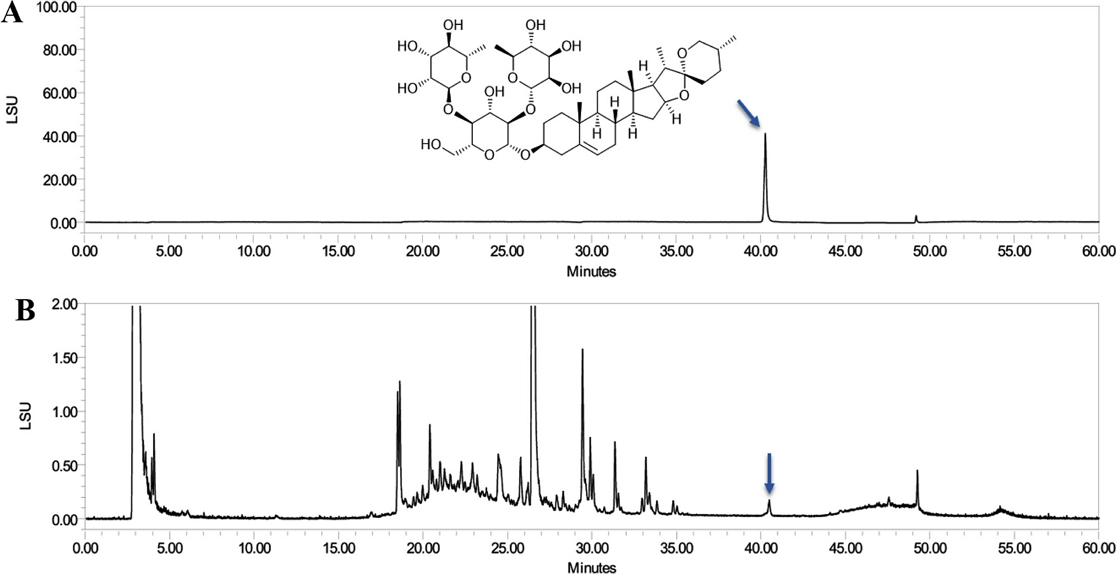
HPLC/ELSD chromatograms. (A) Purity chromatogram of dioscin. (B) Extract chromatogram of S. china rhizomes.
cyclic nucleotides 생성에 대한 dioscin의 영향 - 사람 혈소판 세포 내에서 cAMP 및 cGMP와 같은 cyclic nucleotides가 세포질 내의 Ca2+ 동원을 억제시킴으로써 혈소판 응집을 저해한다는 것과, 이 과정에서 cAMP 의존적인 protein kinase A (PKA) 및 cGMP 의존적인 protein kinase G (PKG)의 활성화가 관련되어 있다고 보고되어 있다.21)
본 연구에서는 dioscin가 혈소판 활성화를 억제한다고 알려진 cAMP 및 cGMP 수준에 어떤 영향을 미치는지 조사하였고, Fig. 2에 나타낸 연구 결과에 따르면 dioscin은 cAMP 생성을 크게 향상시켜 cAMP을 3.09±0.54 pmoL/108 cells에서 5.76±0.04 pmoL/108 cells까지 증가시켰고, cGMP 생성을 2.83±0.53 pmoL/108 cells에서 4.53±0.20 pmoL/108 cells까지 증가시켰다. 이러한 결과를 통해 dioscin이 cAMP 및 cGMP의 생성을 촉진함으로써 혈소판 활성화를 억제에 기여한다는 것을 확인하였다.
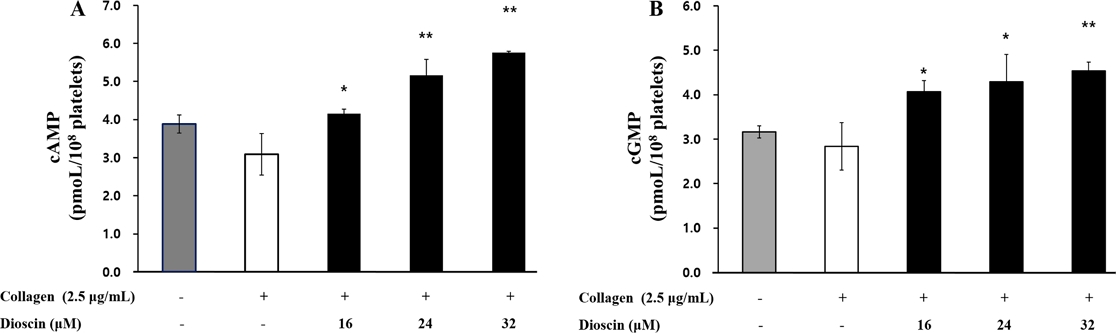
Effects of dioscin on cyclic nucleotides production. (A) Effects of dioscin on cAMP production. (B) Effects of dioscin on cGMP production. Results were presented as mean ± SD (n=4). Statistical significance was indicated as follows: ap<0.05 compared to non-stimulated platelets, *p<0.05, **p<0.001 compared to collagen-induced platelets.
세포 내 Ca2+ 동원과 IP3R의 인산화에 대한 dioscin의 영향 - 사람 혈소판 막에 존재하는 인지질 중 하나인 phosphatidylinositol 4,5-bisphosphate (PIP2)가 phospholipase C-γ2 (PLC-γ2)에 의해 가수분해되면 diacylglycerol과 inositol 1, 4, 5-triphosphate (IP3)의 생성 및 분비의 촉진으로 이어진다.21) 혈소판 내 dense tubular system에 위치하고 있는 IP3 receptor (IP3R)에 IP3의 결합이 촉진될 때, 세포질로의 calcium 동원 ([Ca2+]i)이 유도되어 calcium/calmodulin 의존성 단백질로 알려진 myosin light chain 및 pleckstrin와 같은 세포골격 단백질들이 인산화되면서 혈소판 응집으로 이어진다.22)
Dioscin이 세포 내로의 Ca2+ 동원에 어떤 영향을 미치는 지 한 결과, Fig. 3A는 collagen 자극으로 인해 [Ca2+]i가 46.02±5.81 nM에서 373.30±66.60 nM으로 크게 증가했음을 보여준다. 그러나 dioscin (8-32 μM)을 투여하였을 때, collagen에 의해 상승된 [Ca2+]i가 유의하게 감소되었다(Fig. 3A). 또한, dioscin이 [Ca2+]i 조절에 관여하는 수용체로 알려진 IP3R의 인산화에 미치는 영향을 확인한 결과, Fig. 3B에 나타낸 바와 같이, collagen으로 자극된 혈소판에서 dioscin이 IP3R 인산화를 농도 의존적으로 증가시켰다. 이러한 결과는 dioscin이 IP3R를 인산화시킴으로써 세포 내 Ca2+동원을 억제한다 것을 보여준다.
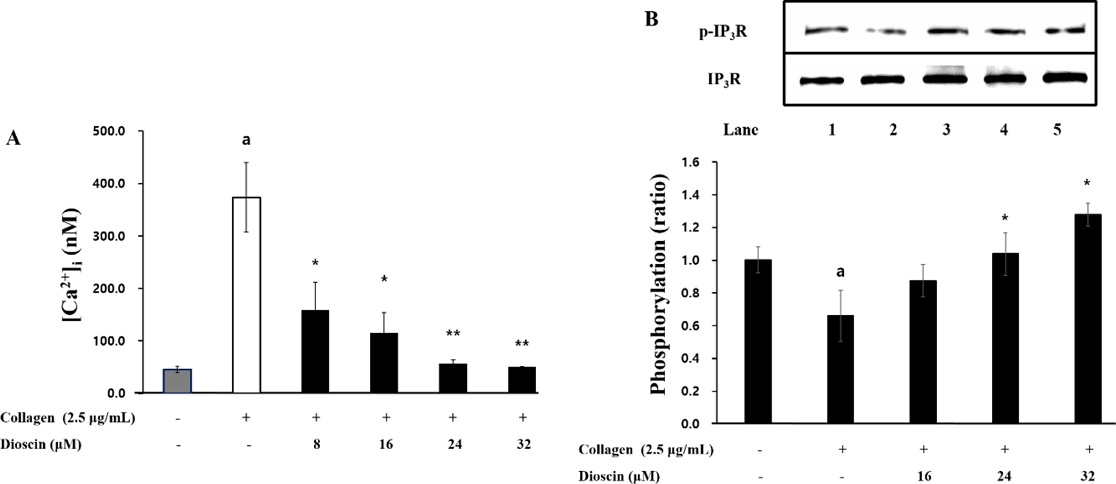
Effects of dioscin on intracellular Ca2+ mobilization and IP3R phosphorylation (A) Effects of dioscin on intracellular Ca2+ mobilization. (B) Effects of dioscin on IP3R phosphorylation. Results were presented as mean ± SD (n=4). Statistical significance was indicated as follows: ap<0.05 compared to non-stimulated platelets, *p<0.05, **p<0.001 compared to collagen –induced platelets.
VASP 인산화에 대한 dioscin의 영향 - 발표된 이전 연구들에서, VASP가 cAMP 및 cGMP-의존성인 PKA 및PKG의 기질로서 혈소판 분비와 점착에 관여할 뿐 아니라 integrin αIIb/β3의 비활성화를 일으켜 혈소판 응집을 억제한다는 보여준다.23,24) 본 연구를 통해, dioscin이 collagen 유도의 혈소판에서 cAMP와 cGMP를 강하게 농도의존적으로 증가시키는 것을 알 수 있었다(Fig. 2).
또한, dioscin이 collagen 유도의 혈소판에서 VASP 인산화에 관여하는지 실험하였고, Fig. 4는 dioscin이 VASP Ser157 및 VASP Ser239 인산화에 유의한 증가를 가지고 왔음을 보여준다. 특히, 16 μM 이상에서 dioscin이 유의적인 효과를 보여주었고, 이는 dioscin에 의한 cAMP 및 cGMP의 생성증가에 기인한 것임을 알 수 있다.
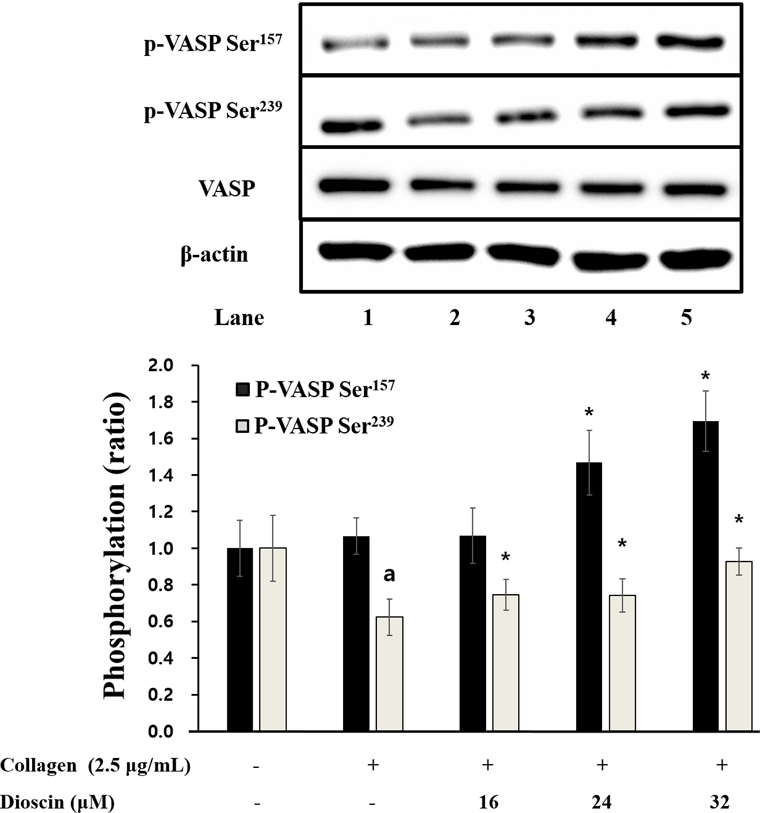
Effects of dioscin on VASP phosphorylation. Results were expressed as mean ± SD (n=4). Statistical significance was indicated as follows: ap<0.05 compared to non-stimulated platelets, *p<0.05, **p<0.001 compared to collagen-induced platelets.
Fibrinogen의 αIIb/β3에 결합능에 대한 dioscin의 영향 - VASP가 인산화 되는 경우에 integrin αIIb/β3의 친화도가 약해져 혈소판 응집이 저해된다는 것으로 잘 알려져 있다.23,24) 혈소판 막 αIIb/β3가 활성화 될 때, 혈소판 내 신호 전달이 이루어짐으로써 세포 골격의 변형을 유도되어 혈소판의 응집과 혈전 생성이 일어난다고 알려져 있다.25) 휴지상태의 혈소판에서 낮은 친화도였던 αIIb/β3가 혈소판이 활성화 되어 inside-out 신호전달 경로가 촉진되면서 구조적인 변형을 야기하고 αIIb/β3 친화도의 상승을 일으키는 것으로 알려져 있다.26) αIIb/β3의 친화도가 높아질 때, fibrinogen와 결합이 잘 일어나고 추가적인 혈소판 세포골격의 형태 변화를 통해 응집이 촉진된다. 앞선 연구에서, 몇 몇 flavonoids는 혈소판 응집을 억제하는 것으로 밝혀졌으며, 그 항혈전 특성에서 혈소판 막의 세포 수용체와의 상호 작용과 관련이 있음을 확인하였다.27-29)
본 연구에서 dioscin에 의한 VASP 인산화의 증가가 αIIb/β3 수용체에 결합하는 fibrinogen의 결합 정도에 어떤 영향을 미쳤는지 확인하였다. Collagen의 자극에 의해 αIIb/β3 수용체에 대한 fibrinogen의 결합력이 61.73±0.91%로 높아졌다(Fig. 5A-b, 5B). 그러나, Fig. 5A-f 및 5B가 보여주는 것과 같이 dioscin은 fibrinogen의 결합력을 농도 의존적 억제하였다. 특히, 32 μM 농도의 dioscin은 fibrinogen 결합을 68.9%까지 감소시켰고(Fig. 5A-f, 5B), 이러한 결과는 αIIb/β3 수용체에 대한fibrinogen의 결합력이 dioscin에 의해 억제되었음을 나타내며, 이는 VASP의 인산화로 인한 것임을 예상해 볼 수 있다.
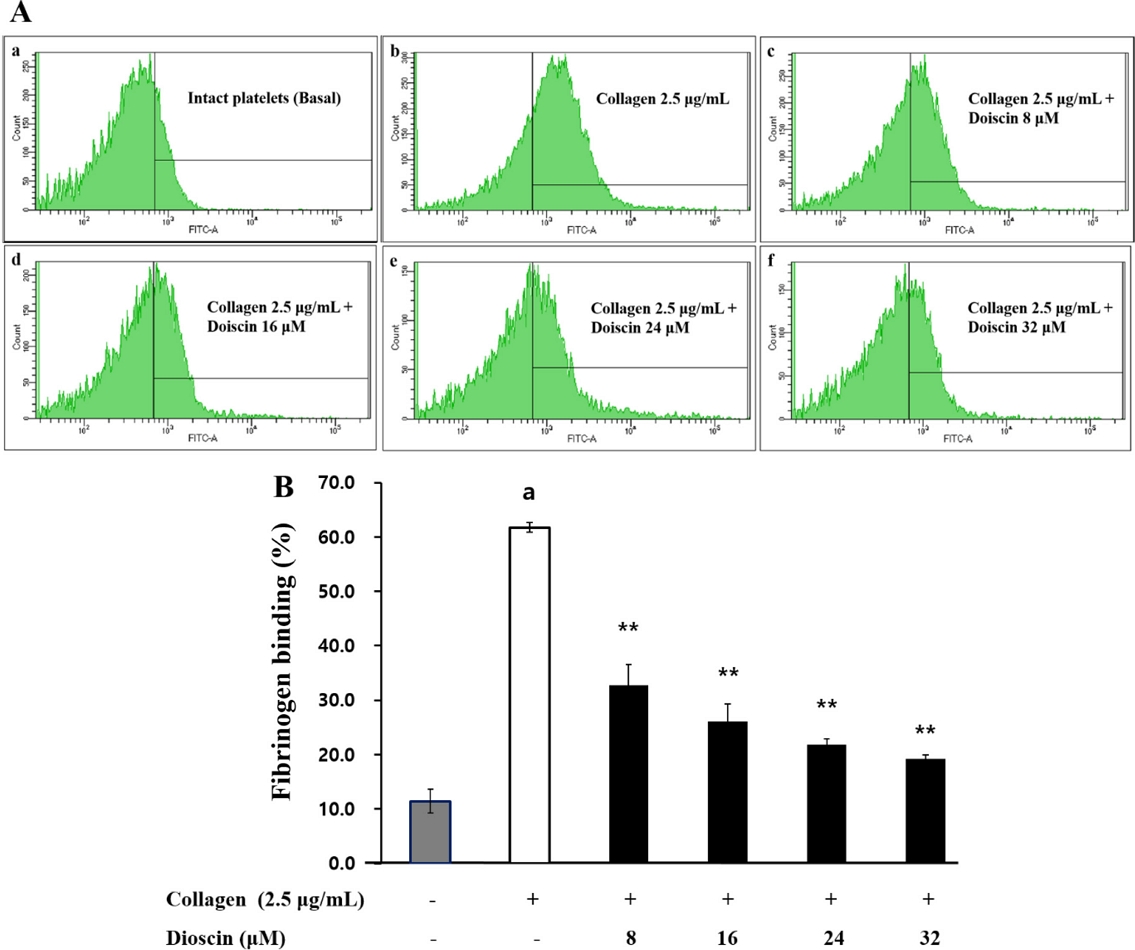
Effects of dioscin on fibrinogen binding. (A) The flow cytometry histograms on fibrinogen binding. a, Intact platelets (base); b, collagen; c, collagen + dioscin (8 μM); d, collagen + dioscin (16 μM); e, collagen + dioscin (24 μM); f, collagen + dioscin (32 μM). (B) Effects of dioscin on U46619-induced fibrinogen binding (%). Results were expressed as mean ± SD (n=4). Statistical significance was indicated as follows: ap<0.05 compared to non-stimulated platelets, *p<0.05, **p<0.001 compared to collagen-induced platelets.
혈소판 매개의 fibrin clot 형성에 대한 dioscin의 영향 - Integrin αIIb/β3에 의해 매개되는 세포 내 신호 전달이 혈소판 세포 골격의 재배열을 유도하고 혈소판 응집 및 혈전 형성에 일으킨다고 알려져 있다.30) 활성화된 혈소판이 축적되면서 fibrin과 혈소판의 그물망을 형성하게 되어 손상된 혈관을 복구시키는 과정이 일어나며, αIIb/β3 친화력을 떨어뜨리는 물질이 혈전 형성을 방지한다고 보고되었다.31)
혈소판 응집유도제에 의해 혈소판이 활성화되면서 응집이 촉발되어fibrin 응고를 형성할 때, 이를 억제해 주는 효과 물질을 확인한 연구에서도 응집유도제로서 thrombin을 사용하였고, thrombin이 응고작용까지 일으키는 강력한 응집유도제 인 것을 참고하여, 본 연구에서도 thrombin가 유도한 fibrin 응고 형성에서 dioscin가 억제 효과를 나타내는지 확인하였다.32) Fig. 6A에 제시한 바와 같이, thrombin은 fibrin 응고를 강하게 일으켰는데, 다양한 농도(16, 24 및 32 μM)의 dioscin을 처리했을 때 fibrin 응고가 형성된 정도가 농도의존적으로 감소하는 것을 확인하였다(Fig. 6B). 이러한 결과는 dioscin이 혈전 형성을 저해하는 효과적인 물질임을 시사한다.
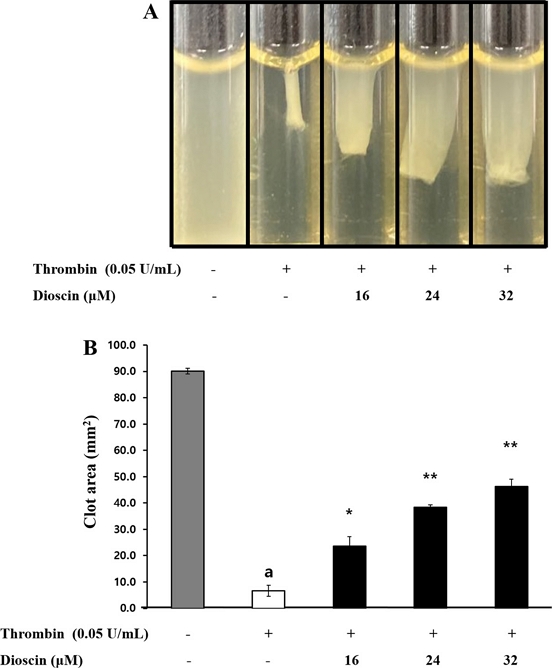
Effects of dioscin on platelet-mediated fibrin clot formation. (A) Effects of dioscin on thrombin-retracted fibrin clot photographs (B) Effects of dioscin on thrombin-retracted fibrin clot area. Results were expressed as mean ± SD (n=4). Statistical significance was indicated as follows: ap<0.05 compared to non-stimulated platelets, *p<0.05, **p<0.001 compared to thrombin-induced platelets.
결 론
지혈과정이 일어나는 과정에서 혈소판의 활성화가 일어나는 것이 정상적인 반응이지만, 과도하거나 비정상적으로 혈소판의 활성화되면 여러 심혈관계 질환을 유발시키기도 한다. 그러므로, 혈소판 활성화를 조절하여 감소시킬 수 있는 새로운 물질의 발굴과 적용이 심혈관 질환의 예방과 치료에 중요하다. 이전 연구에서는 dioscin이 종양 관련 세포의 성장을 억제하고 세포 사멸을 유도한다는 것을 밝혀왔다. 또한, dioscin의 항혈소판 효과에 대한 연구가 소수 보고되었으나 혈소판 활성화 기전을 사람 혈소판을 사용하여 규명한 연구는 없기에, 이 연구에서 dioscin이 사람 혈소판의 활성화를 조절하여 항혈전 효과를 가지는 지 확인하고 그 기전을 파악하여 항혈전제로 개발할 수 있는 잠재력을 확인하려 하였다. 모든 연구는 사람의 혈소판 현탁액으로 수행되었다. Dioscin은 사람 혈소판에서 cAMP와 cGMP를 증가시켜 IP3R 인산화를 유도함으로써 세포질로의 Ca2+ 이동을 방지하고 VASP 인산화를 유도하여 인테그린 αIIb/β3와 fibrinogen 간의 결합을 억제하였다. 마지막으로 dioscin은 thrombin으로 유도된 fibrin 혈전 형성을 상당히 억제하는 것으로 나타났다. 결론적으로 dioscin은 다양한 신호 분자와 관련 단백질의 인산화를 조절하여 혈전 형성을 늦추거나 중단시킬 수 있는 항혈소판 효과를 가지고 있다. 따라서, 이 연구는 dioscin이 항혈전제로서 개발될 수 있는 잠재적인 가치가 있음을 제시한다.
Acknowledgments
Funding for this paper was provided by Namseoul University
Conflict of interest : No conflict of interest.
References
-
Jackson, S. P. (2011) Arterial thrombosis-insidious, unpredictable and deadly. Nat. Med. 17: 1423–1436.
[https://doi.org/10.1038/nm.2515]

-
Schwartz, S. M., Heimark, R. L. and Majesky, M. W. (1990) Developmental mechanisms underlying pathology of arteries. Physiol. Rev. 70: 1177–1209.
[https://doi.org/10.1152/physrev.1990.70.4.1177]

-
Payrastre, B., Missy, K., Trumel, C., Bodin, S. and Plantavid, M. and Chap, H. (2000) The integrin alpha IIb/beta 3 in human platelet signal transduction. Biochem. Pharmacol. 60: 1069–1074.
[https://doi.org/10.1016/s0006-2952(00)00417-2]

-
Jennings, L. K. (2009) Role of platelets in atherothrombosis. Am. J. Cardiol. 103: 4A–10A.
[https://doi.org/10.1016/j.amjcard.2008.11.017]

-
Morello, F., Perino, A. and Hirsch, E. (2009) Phosphoinositide 3-kinase signalling in the vascular system. Cardiovasc Res 82:261–271.
[https://doi.org/10.1093/cvr/cvn325]

-
Sabatine, M. S. and Jang, I. K. (2000) The use of glycoprotein IIb/IIIa inhibitors in patients with coronary artery disease. Am. J. Med. 109: 224–237.
[https://doi.org/10.1016/s0002-9343(00)00474-5]

-
Schwarz, U. R., Walter, U. and Eigenthaler, M. (2001) Taming platelets with cyclic nucleotides. Biochem. Pharmacol. 62: 1153–1161.
[https://doi.org/10.1016/S0006-2952(01)00760-2]

-
Quinton, T. M. and Dean, W. L. (1992) Cyclic AMP-dependent phosphorylation of the inositol-1,4,5-trisphosphate receptor inhibits Ca2+ release from platelet membranes. Biochemical and Biochem. Biophys. Res. Commun. 184893–899.
[https://doi.org/10.1016/0006-291X(92)90675-B]

-
Cavallini, L., Coassin, M., Borean, A. and Alexandre, A. (1996) Prostacyclin and sodium nitroprusside inhibit the activity of the platelet inositol 1,4,5-trisphosphate receptor and promote its phosphorylation. J. Biol. Chem. 271: 5545–5551.
[https://doi.org/10.1074/jbc.271.10.5545]

-
Laurent, V., Loisel, T. P., Harbeck, B., Wehman, A., Gröbe, L., Jockusch, B. M,, Frank, J. W., Gertler, B. and Carlier, M. F. (1999) Role of proteins of the Ena/VASP family in actin-based motility of Listeria monocytogenes. J. Cell. Biol. 144: 1245–1258.
[https://doi.org/10.1083/jcb.144.6.1245]

-
Sudo, T., Ito, H. and Kimura, Y. (2003) Phosphorylation of the vasodilator-stimulated phosphoprotein (VASP) by the anti-platelet drug, cilostazol, in platelets. Platelets 14: 381–390.
[https://doi.org/10.1080/09537100310001598819]

-
Tao, X., Xu, L., Yin, L., Han, X., Qi, Y., Xu, Y., Song, S., Zhao, Y. and Peng, J. (2017) Dioscin induces prostate cancer cell apoptosis through activation of estrogen receptor-β. Cell Death. Dis. 8: e2989.
[https://doi.org/10.1038/cddis.2017.391]

-
Cui, L., Yang, G., Ye, J., Yao, Y., Lu, G., Chen, J., Fang, L., Lu, S. and Zhou, J. (2020) Dioscin elicits anti-tumour immunity by inhibiting macrophage M2 polarization via JNK and STAT3 pathways in lung cancer. J. Cell. Mol. Med. 24: 9217-9230.
[https://doi.org/10.1111/jcmm.15563]

-
Liu, W., Zhao, Z., Wang, Y., Li, W., Su, Q., Jia, Q., Zhang, J., Zhang, X., Shen, J. and Yin, J. (2018) Dioscin inhibits stem-cell-like properties and tumor growth of osteosarcoma through Akt/GSK3/β-catenin signaling pathway. Cell. Death. Dis. 9: 343.
[https://doi.org/10.1038/s41419-018-0363-x]

-
Hsieh, M. J., Tsai, T. L., Hsieh, Y. S., Wang, C. J. and Chiou, H. L. (2013) Dioscin-induced autophagy mitigates cell apoptosis through modulation of PI3K/Akt and ERK and JNK signaling pathways in human lung cancer cell lines. Arch. Toxicol. 87: 1927-1937.
[https://doi.org/10.1007/s00204-013-1047-z]

- Wang, J. J., Liu, Y. X., Wen, D., Yu, H. S., Kang, L. P., Pang, X., Yang, Z., Ma, B. P. and Chen, Y. D. (2014) Study on steroidal saponins from Disocorea zingberensis and their platelet aggregation activities. Zhongguo. Zhong. Yao. Za. Zhi. 39: 3782-3787.
-
Luo, H., Chen, J., Su, C. and Zha, L. (2022) Advances in the bioactivities of phytochemical saponins in the prevention and treatment of atherosclerosis. Nutrients 14: 4998.
[https://doi.org/10.3390/nu14234998]

-
Lee, C. D., Uy, N. P., Lee, Y., Lee, D. H. and Lee, S. (2024) Comparative analysis of phytochemical composition and antioxidant properties of Smilax china rhizome from different regions. Horticulturae 10: 850.
[https://doi.org/10.3390/horticulturae10080850]

-
Kim, H. H., Hong, J. H., Ingkasupart, P., Lee, D. H. and Park, H. J. (2014) Inhibitory effects of Water Extract from Rice Bran due to cAMP-dependent phosphorylation of VASP (Ser157) on ADP-induced platelet aggregation. Biomed. Sci. Lett. 20: 129–138.
[https://doi.org/10.15616/BSL.2014.20.3.129]

-
Berridge, M. J. and Irvine, R. F. (1989) Inositol phosphates and cell signalling. Nature 341: 197–205.
[https://doi.org/10.1038/341197a0]

-
Kuo, J. F., Andersson, R. G., Wise, B. C., Mackerlova, L., Salomonsson, I., Brackett, N. L., Katoh, N., Shoji, M. and Wrenn, R. W. (1980) Calcium-dependent protein kinase: widespread occurrence in various tissues and phyla of the animal kingdom and comparison of effects of phospholipid, calmodulin, and trifluoperazine. Proc. Natl. Acad. Sci. 77: 7039–7043.
[https://doi.org/10.1073/pnas.77.12.7039]

-
Nishikawa, M., Tanaka, T. and Hidaka, H. (1980) Ca2+-calmodulin-dependent phosphorylation and platelet secretion. Nature 287: 863–865.
[https://doi.org/10.1038/287863a0]

-
Wentworth, J. K., Pula, G. and Poole, A. W. (2006) Vasodilator-stimulated phosphoprotein (VASP) is phosphorylated on Ser157 by protein kinase C-dependent and-independent mechanisms in thrombin-stimulated human platelets. Biochem. J. 393: 555–564.
[https://doi.org/10.1042/BJ20050796]

-
Napeñas, J., Oost, F. C., DeGroot, A., Loven, B., Hong, C. H., Brennan, M. T., Lockhart, P. B. and van Diermen, D. E. (2013) Review of postoperative bleeding risk in dental patients on antiplatelet therapy. Oral. Surg. Oral. Med. Oral. Pathol. Oral. Radiol. 115: 491–499.
[https://doi.org/10.1016/j.oooo.2012.11.001]

-
Calderwood, D. A. (2004) Integrin activation. J. Cell. Sci. 117: 657–666.
[https://doi.org/10.5483/bmbrep.2014.47.12.241]

-
Phillips, D. R., Nannizzi-Alaimo, L. and Prasad, K. S. (2001) Beta3 tyrosine phosphorylation in alphaIIbbeta3 (platelet membrane GP IIb-IIIa) outside-in integrin signaling. Thromb. Haemost. 86: 246–258.
[https://doi.org/10.1055/s-0037-1616222]

-
Lee, D. H. (2023) Antithrombotic effect of artemisinin through phosphoprotein regulation in U46619-induced platelets. Biomed. Sci. Lett. 29: 184–189.
[https://doi.org/10.15616/BSL.2023.29.3.184]

-
Yoon, S. S., Kwon, H. W., Shin, J. H., Rhee, M. H., Park, C. E. and Lee, D. H. (2022) Anti-thrombotic effects of artesunate through regulation of cAMP and PI3K/MAPK pathway on human platelets. Int. J. Mol. Sci. 23: 1586.
[https://doi.org/10.3390/ijms23031586]

-
Lee, D. H. (2019) Inhibitory effect of scopoletin on U46619-induced platelet aggregation through regulation of Ca2+ mobilization. Biomed. Sci. Lett. 25: 123–130.
[https://doi.org/10.15616/BSL.2019.25.2.123]

-
Calderwood, D. A. (2004) Integrin activation. J. Cell. Sci. 117: 657-666.
[https://doi.org/10.1242/jcs.01014]

-
Landolfi, R., Mower, R. L. and Steiner, R. (1984) Modification of platelet function and arachidonic acid metabolism by bioflavonoids: structure-activity relations. Biochem. Pharmacol. 33: 1525–1530.
[https://doi.org/10.1016/0006-2952(84)90423-4]

-
Ko, S. N., Son, J. W., Kim, G. R., Kim, M. S., Lee, Y. J., Kim, S. J., Shin, J. H., Jo, D. I., Bok, W. Y., Oh, H. G. and Kwon, H. W. (2023) The inhibitory effects of Glycyrrhiza uralensis on human platelet aggregation and thrombus formation. Biomed. Sci. Lett. 29: 242–248.
[https://doi.org/10.15616/BSL.2023.29.4.242]
