LPS로 염증반응이 유도된 RAW264.7 대식세포와 마우스에서 쇠채아재비 메탄올 추출물의 염증 예방 효과
Abstract
Inflammation is a critical immune response to harmful stimuli such as infections or injuries. However, excessive inflammation can lead to tissue damage, chronic diseases, and systemic inflammatory response syndrome, resulting in multiple organ dysfunction. This dysregulated response can trigger a massive inflammatory cascade, which may prove fatal. Current anti-inflammatory treatments can alleviate symptoms but often have adverse effects, including gastrointestinal and cardiovascular complications. Tragopogon dubius Scop. (T. dubius) is a flowering plant from the Asteraceae family with edible stems. Despite reports of its effectiveness against periodontitis, overall bioactivity beyond this application remains insufficiently explored. This study investigates the anti-inflammatory properties and underlying mechanisms of T. dubius extract in lipopolysaccharide (LPS)-induced RAW 264.7 macrophages and ICR mice. The methanolic extract of T. dubius inhibited LPS-stimulated inflammatory mediator nitric oxide (NO) without exhibiting cytotoxicity under 1,000 μg/mL. It also decreased the expression of inducible NO synthase (iNOS) and interleukin-6 (IL-6) at both mRNA and protein levels. Additionally, the T. dubius methanolic extract inhibited the phosphorylation of c-Jun N-terminal kinase (JNK) and Nuclear factor kappa B (NF-κB) in LPS-stimulated RAW 264.7 macrophages. Furthermore, T. dubius methanolic extract mitigated weight loss and significantly improved survival rates in the LPS-induced inflammatory animal model. It also reduced the levels of NO and IL-6 in the plasma. Overall, the findings suggest that T. dubius methanolic extract has significant anti-inflammatory properties, primarily through inhibiting the JNK/NF-κB signaling pathway.
Keywords:
Inflammation, NF-κB, IL-6, Tragopogon dubius, Lipopolysaccharide염증(Inflammation)은 감염 물질이나 병원균과 같은 외부 인자에 대한 숙주의 방어 기작으로, 손상된 조직을 복구하고 재생하는 생체 반응이다.1) 그러나 염증반응이 조절되지 못하고 장기간 지속되면 체내 유해 물질의 축적으로 인해 조직 손상과 기능 이상을 초래한다.2) 이 과정에서 중요한 역할을 하는 대식세포(macrophage)는 체내 모든 조직에 분포하여 이물질이나 세균을 포식하며 면역 반응을 담당한다.3) 그람 음성균의 세포벽 성분인 lipopolysaccharide (LPS)는 면역 세포를 자극하여 extracellular signal-regulated kinase (ERK), Jun N-terminal kinase (JNK), p38 등을 포함하는 mitogen-activated protein kinase (MAPK) family 세포 내 신호 전달 경로를 통해 염증 반응과 관련된 유전자 발현을 유도한다. 이들은 세포 분열, 사멸, 염증 조절에 중요한 역할을 하며, nuclear factor-kappa B (NF-κB) 전사인자를 조절하여 염증성 사이토카인의 발현을 증가시킨다.4,5)
염증이 유발되면 대식세포는 inducible nitric oxide synthase (iNOS)를 발현하고, 염증 매개 물질인 nitric oxide (NO)를 생성한다.6) NO는 혈관 확장, 체내 방어 및 신호 전달을 포함한 다양한 생리적 과정에서 중요한 역할을 하지만, 과도한 NO 생성은 조직 손상과 혈관 투과성 증가로 인한 부종을 일으킨다.7,8) 또한, 염증반응에서 유도되는 염증성 사이토카인 interleukin (IL)-1β 및 IL-6는 다른 염증 매개체들을 유도하고 신호 전달 기능을 담당하는 중요한 역할을 한다.9) 특히 염증반응 초기에 발현되는 IL-6는 선천적 및 후천적 면역 반응에서 중요한 역할을 담당하는 것으로 보고되었다.10) 하지만 체내 IL-6의 과도한 발현은 조직 손상, 발열, 대사의 항진, 심근 억제, 혈액 응고를 야기한다.11) 이런 과도한 발현이 지속적으로 발생하면 패혈증, 췌장염, 관절염과 같은 감염성 질환 및 자가면역 질환을 악화시킬 수 있기 때문에 염증성 사이토카인인 IL-6와 염증 매개 물질인 NO의 조절은 필수적이다.12)
다양한 염증성 질환의 치료에 사용되는 비스테로이드성 항염증제는 염증 억제 효과가 뛰어나지만, 장기간 사용 시 간 및 신장 기능 장애, 면역 억제와 같은 부작용이 보고되었다.13) 이에 최근 몇 년 동안 다양한 생리활성 화합물을 포함하는 천연물의 약리학적 특성을 이용한 염증성 질환 치료제 개발 연구에 대한 관심이 급증하고 있다.14) 천연물은 수천 년간 인류가 활용해 온 안전성 있는 자원으로, 다양한 생리활성 성분들이 염증 매개체를 조절하는 데 중요한 역할을 한다는 연구들이 꾸준히 보고되고 있다.15) 특히, 항염증, 항산화, 항미생물 효과를 가지는 천연 성분들은 체내 염증반응을 조절하는 데 탁월한 효과를 나타내며, 이들 성분을 기반으로 한 새로운 치료 전략이 주목받고 있다.16)
쇠채아재비(Tragopogon dubius Scop.)는 국화과 한 해 또는 두해살이 식물로 서울, 강원도 영월, 충청북도 단양, 경상북도 영주에서 관찰된다. 식품의약품안전처의 식품공전에 따르면 쇠채아재비는 줄기를 식용하는 식물로 등재되어 있으며, 항산화 및 항진균 효능이 보고되었다.17) 특히, 쇠채아재비는 치주 질환을 유발하는 Porphyromonas gingivalis의 생장을 저해하는 효과가 확인되었다.18) 이 균주의 주요 병원성 인자인 LPS는 염증 반응을 유도하는 대표적인 물질로 알려져 있다. 이를 바탕으로 쇠채아재비가 뛰어난 항균 및 항염 효능이 있을 것으로 사료되나, 쇠채아재비의 생리활성 및 기능성에 대한 연구는 미흡한 실정이다. 따라서 본 연구에서는 염증 유도 물질인 LPS를 이용하여 대식세포(RAW 264.7)와 동물 모델에서 쇠채아재비 메탄올 추출물의 항염증 효능을 입증하여 기능성 소재로서의 잠재력을 확인하고자 하였다.
재료 및 방법
실험재료 - 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), LPS는 Sigma Aldrich Co. (St. Louis, MO, USA)에서 구입하였다. Penicillin-streptomycin (P/S), Dulbecco’s phosphate buffered saline (DPBS) Dulbecco’s modified Eagle’s medium (DMEM)는 Welgene (Gyeongsan, Korea)에서 구입하였고, fetal bovine serum (FBS)은 Altas Biologicals (Fort Collins, CO, USA)에서 구입하였다. RNAiso Plus는 Takara Bio Inc. (Kusatsu, Japan)에서, griess reagent는 promega (Madison, WI, USA)에서 구입하였다. PowerSYBR® Green PCR Master Mix는 applied biosystem 제품을 Thermo Fisher Scientific (Rockford, IL, USA)에서 구입하였다. IL-6, iNOS, β-actin primer는 Integrated DNA Technologies (Coralville, IA, USA)에서 구입하였다. TransScript® All-in-one Firest-Strand cDNA synthesis SuperMix for PCR (One-step gDNA Removal)은 TransGen Biotech Co. (Beijing, China)에서 구입하였다. Lysis buffer는 Jubiotech (Daejeon, Korea)에서 구입하였다. ERK, p38, JNK, p65, phosphorylated ERK (p-ERK), phosphorylated p38 (p-p38), phosphorylated JNK (p-JNK), phosphorylated p65 (p-p65), iNOS, β-actin antibody는 Cell Signaling Technology (Danvers, MA, USA)에서 구입하였다.
시료 및 추출물의 제조 - 본 연구에 사용된 쇠채아재비(Tragopogon dubius)는 강원도 영월군 한반도면 쌍용리에서 채집하였다. 채집된 쇠채아재비는 강원대학교 식물 분류학 장근정 박사에 의해 동정되었다. 상온에서 건조한 쇠채아재비 전초를 식물분쇄기(NANIL, Korea)로 마쇄한 후 1 kg을 취하여 삼각플라스크에 넣고 2 L의 메탄올에 침지시켰다. 이후 메탄올 침전물을 감압 여과하고 농축한 뒤, 증류수에 용해하여 동결건조(ILSHIN Lab Co. Ltd., Yangju, Korea)하였다. 쇠채아재비의 메탄올 추출물 수득률은 5.08%이었다. 세포 실험에서는 쇠채아재비 메탄올 추출물을 70% 에탄올에 용해하였고, 동물 실험에서는 0.9% 생리식염수에 용해하여 사용하였다.
세포 배양 및 염증 유도 - 마우스 유래 대식세포 RAW 264.7은 한국세포주은행(Korean Cell Line Bank, KCLB, Seoul, Korea)에서 구입하였다. RAW 264.7 세포는 DMEM에 10%의 FBS와 100 units/mL의 P/S가 포함된 배지를 사용하여 37℃, 5% CO2 조건의 incubator에서 배양하였다.19) LPS로 유도된 RAW 264.7 세포에서 쇠채아재비 메탄올 추출물의 항염증 효능을 평가하기 위해 RAW 264.7 세포(2×106 cells/well)를 6 well cell culture plate에 분주하여 24시간 배양한 뒤, FBS가 포함되지 않은 DMEM으로 교체하여 24시간 재배양하였다. 이후, 다양한 농도의 쇠채아재비 메탄올 추출물(0-1,000 μg/mL)을 1시간 전처리한 후 LPS (1 μg/mL)를 처리하여 염증을 유도하였다.
세포 독성 평가 (Cell viability) - RAW 264.7 세포에 대한 쇠채아재비 메탄올 추출물의 세포독성은 MTT assay을 이용한 세포 생존율로 측정하였다.20) 쇠채아재비 메탄올 추출물은 0-1,000 μg/mL가 되도록 FBS가 포함되지 않은 DMEM에 희석하여 RAW 264.7 세포(2×105 cells/well)에 100 μL씩 분주하여 24시간 노출하였다. 이후, 5 mg/mL의 MTT 용액을 FBS가 포함되지 않은 DMEM과 1:9로 혼합하여 100 μL씩 첨가하고 4시간 재배양하였다. 이후 배양액을 모두 제거하고 99.5% dimethyl sulfoxide (DMSO)와 isopropyl alcohol을 각각 50 μL씩 첨가하여 세포를 완전히 용해시키고 microplate reader (Molecular devices, San Jose, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다. 생존율은 대조군에 대한 흡광도의 차를 백분율로 표시하여 비교 분석하였다.
염증성 사이토카인의 mRNA 발현 분석 - 쇠채아재비 메탄올 추출물을 전처리 후 LPS를 24시간 자극한 RAW 264.7 세포에서 염증성 사이토카인의 유전자 발현을 확인하기 위해 real time-quantitative polymerase chain reaction (RT-qPCR)을 수행하였다. RT-qPCR 수행을 위해 세포 내 mRNA는 Kim et al.의 방법을 따라 획득하였으며 microplate reader를 이용하여 정량한 뒤 TransScript All in one first-strand cDNA synthesis SuperMix for qPCR을 이용하여 20 μL cDNA로 합성하였다.19) 만들어진 cDNA는 pure water 180 μL에 희석하여 사용하였다.
cDNA 4 μL와 pure water 4.4 μL, Power SYBRⓇ Green PCR Master Mix 10 μL를 혼합하고 primer (iNOS, IL-6, or β-actin) 1.6 μL를 넣어 RT-qPCR을 수행하였다. RT-qPCR 조건은 최초 95℃에서 10분간 가열하고 95℃에서 15초, 57℃에서 20초, 72℃ 40초인 cycle을 총 40회 반복 수행한 후 95℃에서 15초, 60℃에서 1분, 95℃에서 15초 1회 수행하였다.21) 각 primer의 sequence는 다음과 같다(Table 1).
Western blot 분석 - RAW 264.7 세포에서 iNOS의 발현과 쇠채아재비 메탄올 추출물의 항염증 작용기전을 확인하기 위해 western blot을 수행하였다. 쇠채아재비 메탄올 추출물을 전처리 후 LPS로 염증을 유도한 세포를 수거하고 lysis buffer를 이용하여 단백질을 추출하였다. LPS 자극은 iNOS 분석에는 24시간, MAPK와 NF-κB 분석에는 1시간 지속하였다.22) 단백질을 Bradford assay로 정량한 뒤 20 μg의 단백질을 10% SDS-PAGE로 크기별로 분리한 후, PVDF membrane에 transfer하였다. 항체의 비특이적 결합을 차단하기 위해 5% skimmed milk로 2시간 동안 반응시켰으며, 3번의 세척 후에 ERK, p-ERK, p38, p-p38, JNK, p-JNK, p65, p-p65, iNOS와 β-actin에 대한 각각의 항체를 4℃에서 overnight 시켰다. PVDF membrane을 세척하고 2차 항체로 상온에서 2시간 동안 반응시킨 후 ECL system으로 반응시켜 LAS-500 mini imager (General Electric, Boston, MA, USA)를 이용하여 이미지화하고 ImageJ (ImageJ 1.51j8, Wayne Rasband National Institutes of Health, USA)를 사용하여 분석하였다.
실험동물 및 전신 염증 유도 - 생후 5주령의 ICR 마우스를 (주)오리엔트바이오(Gapyeong, Korea)로부터 공급받아 실험에 이용하였다. 마우스는 실험기간 동안 온도 23 ± 1℃, 습도 50 ± 10%, 12시간의 명암주기의 안정적인 사육 환경에서 전용 고형사료와 물을 제한없이 섭취하였다. 대조군은 7마리, 이 외 나머지 군은 총 12마리로 설정하여 실험을 진행하였다. 대조군과 LPS 단독 투여군은 실험기간 동안 0.9% 생리식염수를, 쇠채아재비 메탄올 추출물 투여군은 쇠채아재비 메탄올 추출물을 생리식염수에 용해시켜 100, 200 및 400 mg/kg의 용량으로 1일 1회 7일간 경구투여하였다. 이후, 대조군을 제외한 모든 군에 LPS (25 mg/kg)를 복강투여하여 전신 염증을 유도하였다.22) 투여 12시간이 경과한 뒤, 각 실험군 당 4마리씩 희생시켜 혈액 채취를 통한 생화학적 분석을 실시하였으며, 나머지 개체는 72시간 동안 생존율을 관찰하였다. 본 연구는 강원대학교 동물실험윤리위원회로부터 승인을 받아 수행되었다(KW-221102-6).
NO 생성량 측정 - 쇠채아재비 메탄올 추출물로 전처리한 RAW 264.7 세포를 24시간 동안 LPS로 자극하여 염증을 유도한 후, 배양액을 수거하여 생성된 NO의 농도를 정량하였다. NO의 농도는 griess reagent와 1:1 비율로 혼합한 후 540 nm에서 흡광도를 측정하여 sodium nitrite (NaNO2) 표준곡선을 통해 산출하였다.
LPS로 염증을 유도한 전신 염증 동물 모델의 혈액을 10,000 rpm에서 10분, 4℃ 조건에서 원심분리하여 혈장을 얻었다. 혈장 내 NO의 농도는 NO kit (Biomax, Guri, Korea)의 protocol에 따라 정량하였다.
IL-6 생성량 측정 - 쇠채아재비 메탄올 추출물로 전처리한 뒤 24시간 동안 LPS로 자극하여 염증을 유도한 RAW 264.7 세포의 배양액을 수거하여 생성된 IL-6의 농도를 정량하였다. 배양액은 10,000 rpm에서 10분, 4℃ 조건에서 원심분리하여 미립자 응집체를 제거하여 사용하였다. 또한, LPS로 염증을 유도한 전신 염증 동물 모델의 혈액을 원심분리하여 혈장 내 IL-6의 농도를 정량하였다. 세포 배양액 및 혈장 내 IL-6의 농도는 ELISA kit (Invitrogen, Carlsbad, CA, USA)의 protocol에 따라 측정하였다.
통계처리 - 모든 측정값은 평균 ± 표준오차로 나타내었다. 대조군 및 실험군 간의 통계적 유의성 검증은 GraphPad Prism Version 8.0 (GraphPad Software Inc., La jolla, CA, USA)을 통한 One-way analysis of variance (ANOVA)를 사용하여 군간 비교하였고, 생존율의 경우 Two-way ANOVA를 사용하였다. Student-Newman-Keuls test를 통해 실험군 간의 유의적인 차이를 분석하였고, 통계적 유의확률은 P < 0.05 수준에서 판단하였다.
결과 및 고찰
쇠채아재비 메탄올 추출물이 RAW 264.7 세포 생존율에 미치는 영향 - 쇠채아재비 메탄올 추출물이 LPS로 염증을 유도한 RAW 264.7 세포의 생존율에 영향을 미치는 독성을 확인하기 위해 MTT assay를 수행하였다. 생존율이 대조군 대비 70% 이하인 경우 세포 독성이 있다고 판단하였다.23) 추출물을 농도별로 24시간 노출시킨 결과, 1,000 μg/mL 이하에서 독성이 없는 것을 확인하였다(Fig. 1A). 또한, 쇠채아재비 메탄올 추출물을 전처리하고 1시간 후 LPS (1 μg/mL)를 처리했을 때, 세포의 생존율이 LPS 처리군과 비교하여 농도의존적으로 증가하는 것을 확인하였다(Fig. 1B). 따라서 이후의 연구는 쇠채아재비 메탄올 추출물이 세포 생존율에 영향을 끼치지 않는 1,000 μg/mL 이하의 농도로 진행하였다.
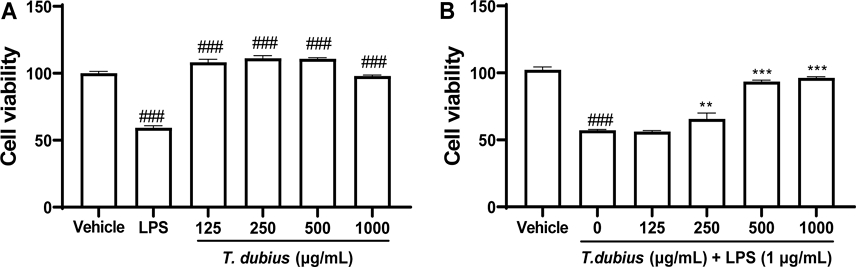
Effect of T. dubis methanolic extract on cell viability in RAW 264.7 cells. (A) Cytotoxicity and (B) cytoprotective effects of T. dubis methanolic extract without/with LPS treatment. ###P < 0.001 vs vehicle, **P < 0.01; ***P < 0.001 vs LPS alone.
쇠채아재비 메탄올 추출물이 LPS로 자극된 RAW 264.7 세포에서 NO 생성과 iNOS 발현에 미치는 영향 - 쇠채아재비 메탄올 추출물이 LPS로 염증을 유도한 RAW 264.7 세포에서 증가된 NO 생성을 억제하는지 확인하기 위해 NO assay를 수행하였다. LPS 단독 처리군의 NO 생성량이 대조군 대비 유의적으로 증가하였고, 쇠채아재비 메탄올 추출물 처리군은 LPS 단독처리군 대비 NO 생성량을 농도의존적으로 감소시키는 것을 확인하였다(Fig. 2A). 이러한 NO 생성량 감소가 합성효소인 iNOS의 발현에 의한 영향인지 확인하기 위해 RT-qPCR을 이용하여 mRNA 발현을 확인하였다. 그 결과, 쇠채아재비 메탄올 추출물 처리군이 농도의존적으로 iNOS의 mRNA 발현을 억제하였다(Fig. 2B). Western blot을 이용하여 단백질 수준에서 확인하였을 때도 이전 결과와 마찬가지로 iNOS의 단백질 발현도 쇠채아재비 메탄올 추출물에 의해 억제되는 것을 확인하였다(Fig. 2C). 이러한 결과는 쇠채아재비 메탄올 추출물이 iNOS를 억제하여 염증매개물질인 NO의 생성을 조절한다는 것을 의미한다.
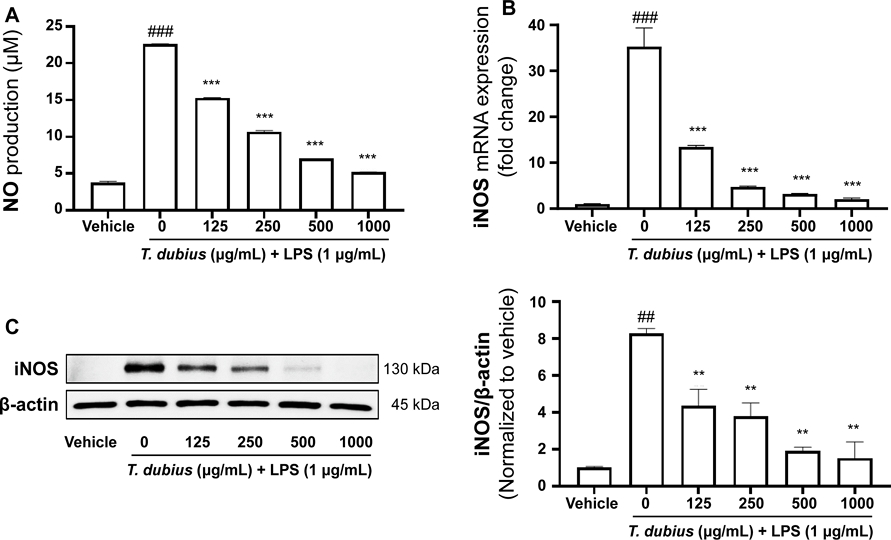
Effects of T. dubius methanolic extract on NO production, mRNA and protein expression of iNOS in LPS-stimulated RAW 264.7 cells. (A) NO production was determined after LPS stimulated for 24 h. (B) The mRNA expression level and (C) relative protein expression of iNOS were analyzed compared to vehicle. ##P < 0.01; ###P < 0.001 vs vehicle, **P < 0.01; ***P < 0.001 vs LPS alone.
쇠채아재비 메탄올 추출물이 LPS로 자극된 RAW 264.7 세포에서 IL-6 발현에 미치는 영향 - 쇠채아재비 메탄올 추출물이 LPS로 염증을 유도한 RAW 264.7 세포에서 염증성 사이토카인 IL-6의 발현을 억제하는지 확인하기 위해 RT-qPCR을 수행하였다. 그 결과, 쇠채아재비 메탄올 추출물이 IL-6의 mRNA 발현을 LPS 단독 처리군 대비 유의적으로 감소시키는 것을 확인하였다(Fig. 3A). 이러한 염증성 사이토카인의 mRNA 발현량 감소가 단백질 생성량에서도 유사한 효과가 있는지 확인하고자 세포 배양액을 수거하여 IL-6의 단백질 발현량을 정량하였다. 그 결과, 쇠채아재비 메탄올 추출물이 농도의존적으로 IL-6의 단백질 생성을 억제하는 것을 확인하였다(Fig. 3B). 한편, 쇠채아재비 메탄올 추출물은 LPS로 유도된 염증성 사이토카인인 TNF-α와 IL-1β의 mRNA 발현량을 감소시키지 않는 것을 확인하였다(data not shown). 따라서 쇠채아재비 메탄올 추출물은 염증반응에서 증가하는 IL-6의 mRNA 발현을 조절하여 단백질 생성을 억제하는 항염 효능이 있음을 의미한다.
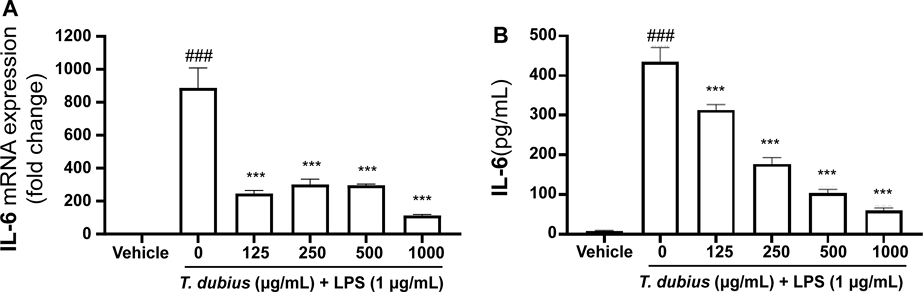
Effects of T. dubius methanolic extract on mRNA and protein expression of IL-6 in LPS-stimulated RAW 264.7 cells. (A) The mRNA expression level and (B) relative protein expression of IL-6 were analyzed using RT-qPCR and ELISA, respectively. ###P < 0.001 vs vehicle, ***P < 0.001 vs LPS alone.
쇠채아재비 메탄올 추출물이 LPS로 자극된 RAW 264.7 세포에서 JNK/NK-κB 신호 경로에 미치는 영향 - LPS는 수용체에 결합 후 MAPK family의 인산화를 조절하고 전사인자인 NF-κB를 활성화하여 최종적으로 염증이 발생된다.24) LPS로 염증을 유도한 RAW 264.7 세포에서 쇠채아재비 메탄올 추출물의 MAPK-NF-κB 신호 전달 체계 관련 작용기전을 확인하고자 western blot assay을 수행하였다. 그 결과, LPS 단독 처리군은 대조군 대비 NF-κB 구성 단백질 중 하나인 p65의 인산화가 유의적으로 증가하는 것을 확인하였고, 쇠채아재비 메탄올 추출물 처리군은 p65의 인산화를 농도의존적으로 억제하였다(Fig. 4A). 이러한 NF-κB 활성화에 대한 쇠채아재비 메탄올 추출물의 억제 효과가 MAPK family의 영향으로 기인한 것인지 추가적으로 확인하였다. LPS 단독 처리군은 대조군 대비 MAPK family인 JNK, ERK, p38의 인산화가 모두 유의적으로 증가하는 것을 확인하였다(Fig. 4B). 하지만 쇠채아재비 메탄올 추출물에 의해서 JNK의 인산화만 농도의존적으로 억제되었다(Fig. 4C). 이와 같은 결과는 쇠채아재비 메탄올 추출물이 MARK family 중 JNK의 인산화를 조절하여 NF-κB의 활성을 억제시켜 항염 효능이 있음을 의미한다.
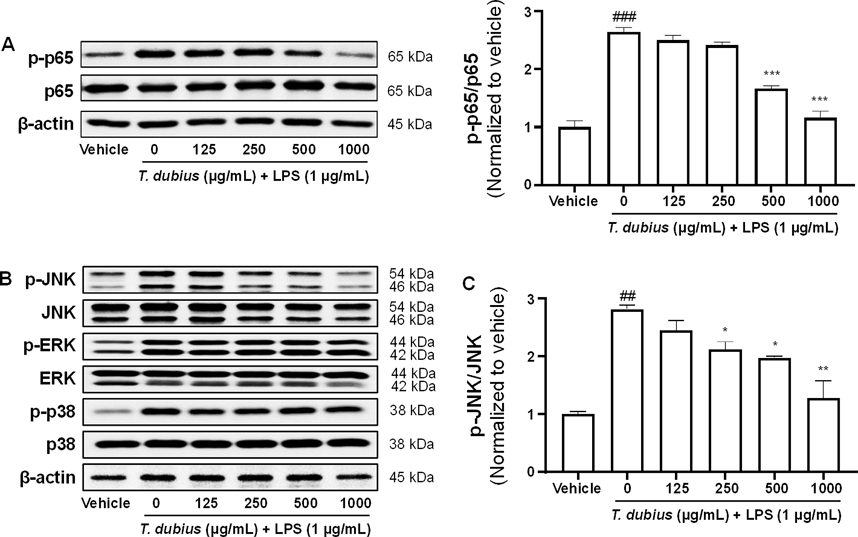
Effect of T. dubius methanolic extract on LPS-stimulated MAPK/NF-κB activations in RAW 264.7 cells. After stimulation with LPS for 1 h, (A) the phosphorylation of p65 (p-p65) was analyzed relative to total p65 levels. (B) The levels of phosphorylated JNK (p-JNK), ERK (p-ERK), and p38 (p-p38) were analyzed, and (C) the relative protein expression levels of p-JNK were quantified. ##P < 0.01; ###P < 0.001 vs vehicle, *P < 0.05; **P < 0.01; ***P < 0.001 vs LPS alone.
쇠채아재비 메탄올 추출물이 LPS로 유발한 전신 염증 동물에서 체중 및 생존율에 미치는 영향 - 감염에 의한 전신 염증이 발병하면 근육통, 발열 증상과 함께 체중이 감소하는 것으로 보고되었다.25) 특히, 체중이 5% 이상 감소한 경우 생존율이 낮다고 보고되었다.26) 따라서 LPS 투여로 전신 염증이 유발된 동물 모델의 체중 변화를 관찰하고, 쇠채아재비 메탄올 추출물이 생존율에 미치는 영향을 확인하였다. 대조군을 제외한 모든 군에 LPS (25 mg/kg)를 복강투여하여 전신 염증을 유도하였고, 12시간 간격으로 72시간 동안 생존율을 확인하였다(Fig. 5A). 기존 보고와 유사하게,27) LPS를 투여하고 12시간 후 체중이 급격히 감소함을 확인하였다(Fig. 5B). 생존율 측정 결과, 쇠채아재비 메탄올 추출물을 각각 100 mg/kg, 200 mg/kg, 400 mg/kg 경구투여한 군에서 각각 68.75%, 75%, 100%로 생존율이 농도의존적으로 증가하는 것을 확인하였다(Fig. 5C). 이는 LPS에 의해 유도된 전신 염증 모델에서 쇠채아재비 메탄올 추출물이 체중 감소를 완화하고 생존율을 향상시킬 수 있음을 의미한다.
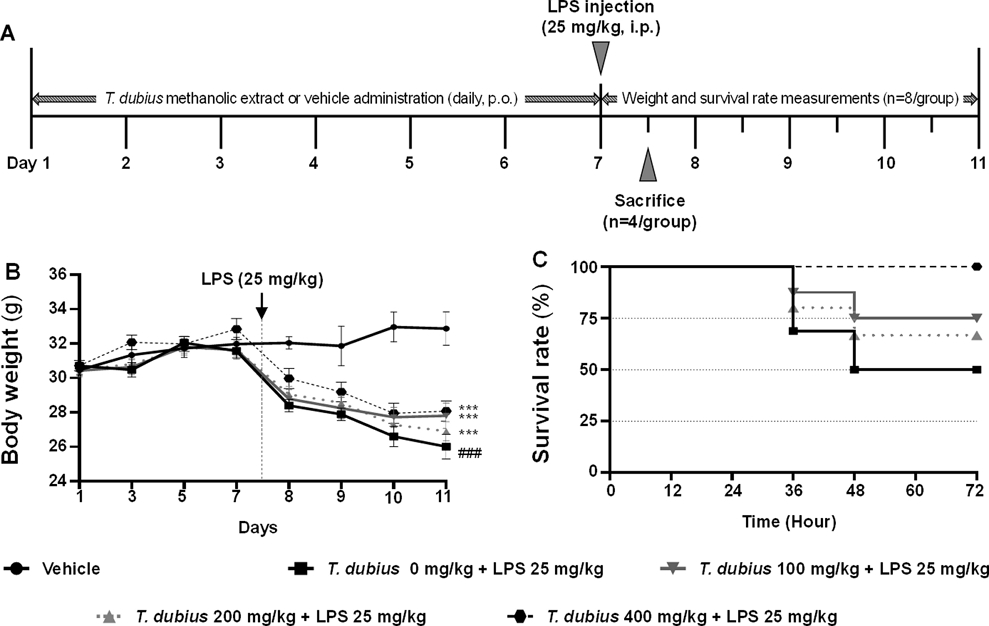
Effects of T. dubius methanolic extract on body whight and survival rate in LPS-induced systemic inflammatory mice. (A) Experimental schedule for the LPS-induced systemic inflammatory mouse model. (B)?Mice were weighed every two days during the administration of T. dubius methanolic extract following LPS injection. (C) The survival rate was measured every 12 h for 3 days (n=8/group). ###P < 0.001 vs vehicle, ***P < 0.001 vs LPS alone.
쇠채아재비 메탄올 추출물이 LPS로 유발한 전신 염증 동물의 혈장에서 NO 및 IL-6 생성에 미치는 영향 - 감염으로 인한 전신 염증이 발병하면 염증반응으로 인해 많은 양의 NO가 생성되어 미생물에 대한 면역 반응이 촉진된다. 또한, 염증이 발병하면 면역 세포가 IL-6를 분비하고, 이는 염증 매개체로서 작용하여 반응을 촉진한다. 때문에 염증성 질환 환자의 혈장에서는 건강한 사람보다 NO와 IL-6의 수치가 높게 나타나게 되고, 이는 염증성 질환의 진단과 치료에 중요한 지표가 된다28). 우리는 in vitro 연구에서 쇠채아재비 메탄올 추출물이 LPS로 인해 증가된 NO 및 IL-6의 발현을 억제하는 것을 확인하였다(Fig. 2, 3). 따라서, 본 연구에서는 쇠채아재비 메탄올 추출물이 LPS로 전신 염증을 유도한 동물 모델에서도 혈장 내 NO와 IL-6의 생성을 억제하는지 확인하였다. 실험 결과, LPS 단독 투여군에서 염증반응이 발생하여 대조군 대비 NO의 생성이 유의적으로 증가하였다(Fig. 6A). 반면, 쇠채아재비 400 mg/kg 경구투여 군에서는 LPS 단독 투여군 대비 NO 생성이 유의적으로 감소하는 것을 확인하였다. 또한, LPS 단독 투여군에서 염증반응이 발생하여 대조군 대비 IL-6 농도가 유의적으로 증가하였으며, 쇠채아재비 400 mg/kg 경구투여 군에서는 LPS 단독 투여군에 비해 IL-6 농도가 유의적으로 감소하는 것을 확인하였다(Fig. 6B). 따라서, 쇠채아재비 메탄올 추출물이 LPS로 전신 염증을 유도한 동물 모델에서 혈장 내 NO와 IL-6 농도를 감소시키는 효능이 있음을 의미한다.
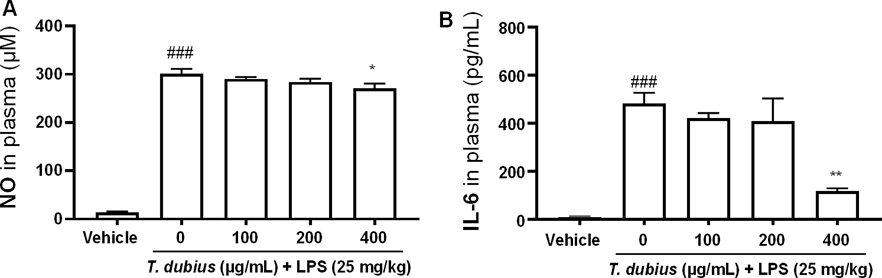
Effects of T. dubius methanolic extract on NO and IL-6 level in plasma of LPS-induced systemic inflammatory mice. (A) NO production and (B) IL-6 level in plasma were determined 12 h after LPS injection (n=4/group). ###P < 0.001 vs vehicle, *P < 0.05; **P < 0.01 vs LPS alone.
만성 염증은 현대 사회에서 다양한 질병의 기초가 되는 중요한 생리적 현상으로, 심혈관 질환, 당뇨병, 자가면역 질환 등과 깊은 연관이 있다29,30). 또한 호흡기, 소화기, 비뇨기 및 혈액을 통한 감염 또는 염증성 사이토카인의 과발현은 사이토카인 폭풍(cytokine storm), 패혈증과 같은 전신적인 염증반응을 유발하여 다양한 증상이 나타날 수 있다.31,32) 선행연구에 따르면 이러한 전신 염증반응의 발병 기전은 명확히 밝혀지지 않았으나, 감염의 부위, 종류, 환자의 면역 상태 등에 따라 다양한 인자가 복합적으로 작용하는 것으로 보고되었다33). 많은 연구에 따르면, 염증성 사이토카인은 전신 염증반응에서 염증반응을 개시하고 조절하는 중요한 역할을 하며, 특히 IL-6의 증가는 조직 손상 및 다발성 장기 부전, 높은 사망률과 밀접한 관련이 있음이 보고되었다.34,35) 이에 따라 전신 염증반응의 효과적인 치료를 위해 염증 매개 물질 및 사이토카인의 과발현 조절이 중요하다36). LPS는 면역 세포를 자극하여 MAPK/NF-κB 신호 전달 체계를 활성화하여 염증 관련 유전자의 발현을 유도한다5). 따라서 대식세포를 포함한 다양한 세포에 LPS를 노출시켜 염증반응의 신호 전달과 항염증 효능을 확인하는 데 자주 사용된다.37,38) 따라서 본 연구에서는 LPS로 염증을 유도한 마우스 대식세포 RAW 264.7 세포에서 쇠채아재비의 항염증 효능을 확인하였다.
쇠채아재비 메탄올 추출물은 LPS로 유도된 RAW 264.7 세포에서 iNOS의 발현을 억제하여 NO 생성을 농도 의존적으로 감소시켰으며, IL-6의 mRNA 및 단백질 생성을 유의적으로 억제하였다. 또한, 쇠채아재비 메탄올 추출물은 MAPK 경로 중 하나인 JNK와 NF-κB의 활성을 농도 의존적으로 조절하여 JNK/NF-κB 신호 전달 경로를 억제하였다. 염증 매개 물질인 NO는 면역 기능을 증진시키고 항균 및 항산화 작용을 통해 염증을 조절하지만, 지나치게 생성될 경우 염증반응이 지속되고 조직이 손상되는 부정적인 영향을 미친다.7) 염증성 사이토카인 IL-6는 면역세포를 감염 부위로 유인하는 접착 분자와 케모카인의 발현을 유도하여 염증을 촉진한다.39) 특히 IL-6는 면역 응답, 조혈계와 신경계 세포의 증식 및 분화 등에 중요한 역할을 한다. 하지만, IL-6가 과발현되면 다양한 면역 이상증, 림프계 종양, 류마티스 관절염과 같은 자가면역 질환이 발생할 수 있다.40,41) 본 연구에서 우리는 쇠채아재비 메탄올 추출물이 RAW 264.7 세포에서 과발현된 NO와 IL-6를 감소시키는 우수한 항염증 효능을 확인하였으며, 이를 바탕으로 염증성 질환의 예방 및 치료에 사용될 수 있을 것으로 사료된다.
이러한 쇠채아재비의 염증 예방 효능을 검증하기 위해, 마우스에게 7일간 쇠채아재비 추출물을 경구 투여한 후 LPS를 사용하여 전신 염증반응을 유발하였다. 쇠채아재비의 염증 예방 효능을 지속적으로 평가하기 위해 7일간 반복투여 되었습니다.42) 고농도의 LPS를 복강 내에 투여하는 동물 모델은 다양한 염증반응을 유발하는 방법으로 여겨지며, 이를 이용하여 감염에 의한 전신 염증반응을 이해하는 기초 모델로 널리 활용된다.43,44) 실험 결과, 쇠채아재비 메탄올 추출물 투여군은 LPS로 유도된 사망률을 농도의존적으로 감소시켰으며, 특히 400 mg/kg 투여군에서는 모든 마우스가 생존하는 것을 확인하였다. 또한, 쇠채아재비 메탄올 추출물 400 mg/kg 투여군의 혈장 내 NO와 IL-6의 수치가 유의적으로 감소한 것을 확인하였다. 이러한 결과는 LPS로 유도된 전신 염증반응을 완화하는 쇠채아재비 메탄올 추출물의 우수한 항염증 효능을 시사하며, 이는 ovalbumin 또는 맹장 결찰 및 천공(cecal ligation and puncture) 같은 다른 염증 유도 모델에서의 추가 연구를 통해 더욱 뒷받침될 수 있을 것이다
쇠채아재비는 전통적으로 이뇨제, 지사제, 항염증제, 항류마티스, 항당뇨, 피부염 및 부기 개선, 상처 치유 등의 목적으로 사용되었으며, 항산화, 항균, 항염, 항암 활성이 보고되었다.45) 최근 UPLC-ESI-QTOF-MS 분석 결과에 따르면, 쇠채아재비 뿌리 메탄올 추출물은 rutin, trans-chlorogenic acid, syringic acid 등 다양한 생리활성 물질을 포함하고 있다.46) 이 중, rutin은 quercetin에 rutinose가 결합된 배당체 구조의 플라보노이드로 항산화, 항염증, 암세포 성장 억제 등의 효능이 보고되어 다양한 대사 질환에 대한 치료 효과가 보고되었다.47) 또한, chlorogenic acid는 NF-κB, MAPK 등을 포함한 주요 신호 경로와 관련인자를 조절하여 IL-1β, IL-6, NO와 같은 염증 매개체의 분비를 조절하는 항염증 효능이 보고되었다.48) Syringic acid는 NF-κB와 JAK-STAT 기전의 억제를 통해 methyl cellosolve로 간 및 고환 염증이 유발된 랫드 (rat)에서 항염증 효능이 보고되었다.49) 이는 본 연구에서 확인한 쇠채아재비 메탄올 추출물이 LPS로 유도한 RAW 264.7 세포와 마우스에서 우수한 항염증 효능을 뒷받침한다.
결 론
결과를 종합하면, 쇠채아재비 메탄올 추출물은 RAW 264.7 세포에서 LPS로 유도된 JNK/NF-κB의 인산화를 조절하여 항염증 효과를 나타냈다. 또한, LPS로 전신 염증을 유발한 동물에서 쇠채아재비 메탄올 추출물의 투여로 혈장 내 NO와 IL-6가 유의적으로 감소하였고 생존율이 농도의존적으로 증가하였다. 이러한 연구 결과는 쇠채아재비 메탄올 추출물이 향후 활성성분 탐색, 동물 모델에서의 항염증 기전 연구, 그리고 임상 시험 등을 통해 염증 치료제로서 개발을 위한 기초자료가 될 수 있을 것으로 사료된다.
Acknowledgments
본 연구는 교육부 및 한국연구재단의 대학중점연구소지원사업(2021R1A6A1A03044242)의 지원을 통해 수행되었으며 이에 감사드립니다.
References
-
Kim, M.-J., Kim, M.-J., Kim, K.-B.-W.-R., Park, S.-H., Choi, H.-D., Park, S.-Y., Kim, J.-H., Jang, M.-R., Im, M.-H. and Ahn, D.-H. (2017) Anti-inflammatory effect of Sargassum patens C. Agardh ethanol extract in LPS-induced RAW264.7 cells and mouse ear edema. Microbiology and Biotechnology Letters 45: 110-117.
[https://doi.org/10.4014/mbl.1610.10002]

-
Brusini, R., Varna, M. and Couvreur, P. (2020) Advanced nanomedicines for the treatment of inflammatory diseases. Advanced Drug Delivery Reviews 157: 161-178.
[https://doi.org/10.1016/j.addr.2020.07.010]

-
Kang, B.-K., Kim, M.-J., Kim, K.-B.-W.-R., Ahn, N.-K., Choi, Y.-U., Bark, S.-W., Pak, W.-M., Kim, B.-R., Park, J.-H. and Bae, N.-Y. (2015) The anti-inflammatory effect of skipjack tuna (Katsuwonus pelamis) oil in LPS-induced RAW 264.7 cells and mouse models. Microbiology and Biotechnology Letters 43: 45-55.
[https://doi.org/10.4014/mbl.1412.12001]

-
Feng, G.-J., Goodridge, H. S., Harnett, M. M., Wei, X.-Q., Nikolaev, A. V., Higson, A. P. and Liew, F.-Y. (1999) Extracellular signal-related kinase (ERK) and p38 mitogen-activated protein (MAP) kinases differentially regulate the lipopolysaccharide-mediated induction of inducible nitric oxide synthase and IL-12 in macrophages: Leishmania phosphoglycans subvert macrophage IL-12 production by targeting ERK MAP kinase. The Journal of Immunology 163: 6403-6412.
[https://doi.org/10.4049/jimmunol.163.12.6403]

-
Tong, W., Chen, X., Song, X., Chen, Y., Jia, R., Zou, Y., Li, L., Yin, L., He, C. and Liang, X. (2020) Resveratrol inhibits LPS‑induced inflammation through suppressing the signaling cascades of TLR4‑NF‑κB/MAPKs/IRF3. Experimental and Therapeutic Medicine 19: 1824-1834.
[https://doi.org/10.3892/etm.2019.8396]

-
Bae, G.-S. and Park, S.-J. (2016) The anti-inflammatory effect of Nypa fruticans Wurmb. fruit on lipopolysaccharide-induced inflammatory response on RAW 264.7 cells. The Korea Journal of Herbology 31: 79-84.
[https://doi.org/10.6116/kjh.2016.31.5.79.]

- Guzik, T., Korbut, R. and Adamek-Guzik, T. (2003) Nitric oxide and superoxide in inflammation. J Physiol Pharmacol. 54: 469-487.
-
Kang, B.-K., Kim, K.-B.-W.-R., Ahn, N.-K., Choi, Y.-U., Kim, M.-j., Bark, S.-W., Pak, W.-M., Kim, B.-R., Park, J.-H. and Bae, N.-Y. (2015) Anti-inflammatory effect of onion (Allium cepa) peel hot water extract in vitro and in vivo. KSBB Journal 30: 148-154.
[https://doi.org/10.7841/ksbbj.2015.30.4.148]

-
Kim, M.-K. and Kim, D.-Y. (2015) Anti-inflammatory effect of barley leaf ethanol extract in LPS-stimulated RAW264.7 macrophage. Korean Journal of Food Preservation 22: 735-743.
[https://doi.org/10.11002/kjfp.2015.22.5.735]

-
Berek, J. S., Chung, C., Kaldi, K., Watson, J. M., Knox, R. M. and Martínez-Maza, O. (1991) Serum interleukin-6 levels correlate with disease status in patients with epithelial ovarian cancer. American Journal of Obstetrics and Gynecology 164: 1038-1043.
[https://doi.org/10.1016/0002-9378(91)90582-C]

- Voss, M. and Cotton, M. (1998) Mechanisms and clinical implications of apoptosis. Hospital Medicine (London, England: 1998) 59: 924-930.
-
Navarro-Millán, I., Singh, J. A. and Curtis, J. R. (2012) Systematic review of tocilizumab for rheumatoid arthritis: a new biologic agent targeting the interleukin-6 receptor. Clinical Therapeutics 34: 788-802. e783.
[https://doi.org/10.1016/j.clinthera.2012.02.014]

-
Bindu, S., Mazumder, S. and Bandyopadhyay, U. (2020) Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective. Biochemical Pharmacology 180: 114147.
[https://doi.org/10.1016/j.bcp.2020.114147]

-
Sorrenti, V., Burò, I., Consoli, V. and Vanella, L. (2023) Recent advances in health benefits of bioactive compounds from food wastes and by-products: Biochemical aspects. International Journal of Molecular Sciences 24: 2019.
[https://doi.org/10.3390/ijms24032019]

-
Atanasov, A. G., Zotchev, S., Dirsch, V. and Supuran, C. (2021) International natural product sciences taskforce. Nat. Rev. Drug Disco., 20: 200-216.
[https://doi.org/10.1038/s41573-020-00114-z]

-
Gonfa, Y. H., Tessema, F. B., Bachheti, A., Rai, N., Tadesse, M. G., Singab, A. N., Chaubey, K. K. and KumarBachheti, R. (2023) Anti-inflammatory activity of phytochemicals from medicinal plants and their nanoparticles: A review. Current Research in Biotechnology 6: 100152.
[https://doi.org/10.1016/j.crbiot.2023.100152]

-
Uysal, S., Senkardes, I., Mollica, A., Zengin, G., Bulut, G., Dogan, A., Glamočlija, J., Soković, M., Lobine, D. and Mahomoodally, F. M. (2019) Biologically active compounds from two members of the Asteraceae family: Tragopogon dubius Scop. and Tussilago farfara L. Journal of Biomolecular Structure and Dynamics 37: 3269-3281.
[https://doi.org/10.1080/07391102.2018.1506361]

- Kim, E., Oh, K., Baek, K. and Kim, Y. (2015) Composition for preventing or treating periodontal disease comprising Tragopogon dubius extract as effective component, Patent 1020150066181.
- Kim, J. Y., Kim, S.-Y. and Park, S. J. (2021) Effects of Trifolium repens and Trifolium pratense on the LPS-induced inflammatory responses in RAW 264.7 macrophages. Journal of Agricultural, Life and Environmental Sciences 33: 409-419.
-
Kim, S. M., Vetrivel, P., Kim, H. H., Ha, S. E., Saralamma, V. V. G. and Kim, G. S. (2020) Artemisia iwayomogi (Dowijigi) inhibits lipopolysaccharide-induced inflammation in RAW264.7 macrophages by suppressing the NF-κB signaling pathway. Experimental and Therapeutic Medicine 19: 2161-2170.
[https://doi.org/10.3892/etm.2020.8472]

-
Kim, S.-Y., Han, S.-D., Kim, M., Mony, T. J., Lee, E.-S., Kim, K.-M., Choi, S.-H., Hong, S. H., Choi, J. W. and Park, S. J. (2021) Mentha arvensis essential oil exerts anti-inflammatory in LPS-stimulated inflammatory responses via inhibition of ERK/NF-κB signaling pathway and anti-atopic dermatitis-like effects in 2, 4-dinitrochlorobezene-induced BALB/c mice. Antioxidants 10: 1941.
[https://doi.org/10.3390/antiox10121941]

-
Choi, S.-H., Kim, S.-Y., Kim, K.-M., Mony, T. J., Bae, H. J., Kim, M. S., Lee, C. H., Choi, S.-E., Lee, S. H. and Park, S. J. (2023) Fermented sprouts of Codonopsis lanceolata suppress LPS-induced inflammatory responses by inhibiting NF-κB signaling pathway in RAW 264.7 macrophages and CD1 mice. Pharmaceutics 15: 1793.
[https://doi.org/10.3390/pharmaceutics15071793]

-
Cho, S.-K., Park, J.-H. and Lim, G.-T. (2018) A evaluation of biological safety in risk management of conventional contact lens containing phosphorylcholine. J. Korean Ophthalmic Opt. Soc. 23: 11-18.
[https://doi.org/10.14479/jkoos.2018.23.1.11]

-
Oeckinghaus, A. and Ghosh, S. (2009) The NF-kappaB family of transcription factors and its regulation. Cold Spring Harb Perspect. Biol. 1: a000034.
[https://doi.org/10.1101/cshperspect.a000034]

-
Summerbell, C., Perrett, J. and Gazzard, B. (1993) Causes of weight loss in human immunodeficiency virus infection. International Journal of Std & Aids 4: 234-236.
[https://doi.org/10.1177/095646249300400412]

-
Osuchowski, M. F., Welch, K., Yang, H., Siddiqui, J. and Remick, D. G. (2007) Chronic sepsis mortality characterized by an individualized inflammatory response. The Journal of Immunology 179: 623-630.
[https://doi.org/10.4049/jimmunol.179.1.623]

-
Strassmann, G., Fong, M., Windsor, S. and Neta, R. (1993) The role of interleukin-6 in lipopolysaccharide-induced weight loss, hypoglycemia and fibrinogen production, in vivo. Cytokine 5: 285-290.
[https://doi.org/10.1016/1043-4666(93)90058-D]

-
Kirkebøen, K. and Strand, Ø. (1999) The role of nitric oxide in sepsis–an overview. Acta Anaesthesiologica Scandinavica 43: 275-288.
[https://doi.org/10.1034/j.1399-6576.1999.430307.x]

-
Furman, D., Campisi, J., Verdin, E., Carrera-Bastos, P., Targ, S., Franceschi, C., Ferrucci, L., Gilroy, D. W., Fasano, A. and Miller, G. W. (2019) Chronic inflammation in the etiology of disease across the life span. Nature Medicine 25: 1822-1832.
[https://doi.org/10.1038/s41591-019-0675-0]

-
Okin, D. and Medzhitov, R. (2012) Evolution of inflammatory diseases. Current Biolog, 22: R733-R740.
[https://doi.org/10.1016/j.cub.2012.07.029]

-
Huet, O. and Chin-Dusting, J. P. (2014) Septic shock: desperately seeking treatment. Clinical Science 126: 31-39.
[https://doi.org/10.1042/CS20120668]

-
Mira, J. C., Gentile, L. F., Mathias, B. J., Efron, P. A., Brakenridge, S. C., Mohr, A. M., Moore, F. A. and Moldawer, L. L. (2017) Sepsis pathophysiology, chronic critical illness, and persistent inflammation-immunosuppression and catabolism syndrome. Critical Care Medicine 45: 253-262.
[https://doi.org/10.1097/CCM.0000000000002074]

-
Robertson, C. M. and Coopersmith, C. M. (2006) The systemic inflammatory response syndrome. Microbes and Infection 8: 1382-1389.
[https://doi.org/10.1016/j.micinf.2005.12.016]

-
Kany, S., Vollrath, J. T. and Relja, B. (2019) Cytokines in inflammatory disease. International Journal of Molecular Sciences 20: 6008.
[https://doi.org/10.3390/ijms20236008]

-
Cohen, J. (2002) The immunopathogenesis of sepsis. Nature 420: 885-891.
[https://doi.org/10.1038/nature01326]

-
Chen, L., Lin, X., Xiao, J., Tian, Y., Zheng, B. and Teng, H. (2019) Sonchus oleraceus Linn protects against LPS-induced sepsis and inhibits inflammatory responses in RAW264.7 cells. Journal of Ethnopharmacology 236: 63-69.
[https://doi.org/10.1016/j.jep.2019.02.039]

-
Zhou, M., Tang, Y., Liao, L., Liu, M., Deng, Y., Zhao, X. and Li, Y. (2021) Phillygenin inhibited LPS-induced RAW 264.7 cell inflammation by NF-κB pathway. European Journal of Pharmacology 899: 174043.
[https://doi.org/10.1016/j.ejphar.2021.174043]

-
Tucureanu, M. M., Rebleanu, D., Constantinescu, C. A., Deleanu, M., Voicu, G., Butoi, E., Calin, M. and Manduteanu, I. (2018) Lipopolysaccharide-induced inflammation in monocytes/macrophages is blocked by liposomal delivery of Gi-protein inhibitor. International Journal of Nanomedicine 13: 63-76.
[https://doi.org/10.2147/IJN.S150918]

-
Darif, D., Hammi, I., Kihel, A., Saik, I. E. I., Guessous, F. and Akarid, K. (2021) The pro-inflammatory cytokines in COVID-19 pathogenesis: What goes wrong? Microbial Pathogenesis 153: 104799.
[https://doi.org/10.1016/j.micpath.2021.104799]

-
Dinarello, C. A. (2000) Proinflammatory cytokines. Chest 118: 503-508.
[https://doi.org/10.1378/chest.118.2.503]

-
Heinrich, P. C., Behrmann, I., Haan, S., Hermanns, H. M., Müller-Newen, G. and Schaper, F. (2003) Principles of interleukin (IL)-6-type cytokine signalling and its regulation. Biochemical Journal 374: 1-20.
[https://doi.org/10.1042/bj20030407]

-
Kim, K. M., Kim, S. Y., Mony, T. J., Bae, H. J., Han, S. D., Lee, E. S., Choi, S. H., Hong, S. H., Lee, S. D., Park, S. J. (2021) Dracocephalum moldavica ethanol extract suppresses LPS-induced inflammatory responses through inhibition of the JNK/ERK/NF-κB signaling pathway and IL-6 production in RAW 264.7 macrophages and in endotoxic-treated mice. Nutrients 13: 4501.
[https://doi.org/10.3390/nu13124501]

-
Zhang, X., Tian, X., Wang, Y., Yan, Y., Wang, Y., Su, M., Lv, H., Li, K., Hao, X. and Xing, X. (2024) Application of lipopolysaccharide in establishing inflammatory models. International Journal of Biological Macromolecules 279: 135371.
[https://doi.org/10.1016/j.ijbiomac.2024.135371]

-
Rafiyan, M., Sadeghmousavi, S., Akbarzadehmoallemkolaei, M. and Rezaei, N. (2023) Experimental animal models of chronic inflammation. Current Research in Immunology 4: 100063.
[https://doi.org/10.1016/j.crimmu.2023.100063]

-
Abdalla, M. A. and Zidorn, C. (2020) The genus Tragopogon (Asteraceae): a review of its traditional uses, phytochemistry, and pharmacological properties. Journal of Ethnopharmacology 250: 112466.
[https://doi.org/10.1016/j.jep.2019.112466]

-
Ahmad, S. S., Garg, C., Kour, R., Bhat, A. H., Raja, V., Gandhi, S. G., Ataya, F. S., Fouad, D., Radhakrishnan, A. and Kaur, S. (2024) Metabolomic insights and bioactive efficacies of Tragopogon dubius root fractions: Antioxidant and antiproliferative assessments. Heliyon 10: e34746.
[https://doi.org/10.1016/j.heliyon.2024.e34746]

-
Muvhulawa, N., Dludla, P. V., Ziqubu, K., Mthembu, S. X., Mthiyane, F., Nkambule, B. B. and Mazibuko-Mbeje, S. E. (2022) Rutin ameliorates inflammation and improves metabolic function: A comprehensive analysis of scientific literature. Pharmacological Research 178: 106163.
[https://doi.org/10.1016/j.phrs.2022.106163]

-
Huang, J., Xie, M., He, L., Song, X. and Cao, T. (2023) Chlorogenic acid: a review on its mechanisms of anti-inflammation, disease treatment, and related delivery systems. Frontiers in Pharmacology 14: 1218015.
[https://doi.org/10.3389/fphar.2023.1218015]

-
Somade, O. T., Oyinloye, B. E., Ajiboye, B. O. and Osukoya, O. A. (2023) Syringic acid demonstrates an anti-inflammatory effect via modulation of the NF-κB-iNOS-COX-2 and JAK-STAT signaling pathways in methyl cellosolve-induced hepato-testicular inflammation in rats. Biochemistry and Biophysics Reports 34: 101484.
[https://doi.org/10.1016/j.bbrep.2023.101484]