
Dendrotrophe umbellata (Blume) Miq. 메탄올 추출물이 아세틸콜린에스테라제 활성 및 APP 관련 단백질 대사에 미치는 영향
Abstract
Alzheimer's disease (AD) is the most common form of progressive neurodegenerative disease in the elderly and is characterized by memory and cognitive impairments. In patients with AD, memory and cognitive decline are associated with the formation of senile plaques, which are caused by the aggregation of β-amyloid (Aβ) peptides derived from amyloid precursor protein (APP). Additionally, AD patients exhibit reduced levels of acetylcholine, a neurotransmitter, due to the excessive production of acetylcholinesterase (AChE). In this study, we screened natural products for their inhibitory activities against Aβ secretion and AChE activity. The methanol extract of Dendrotrophe umbellata (Blume) Miq. (DUM) demonstrated inhibitory effects on both Aβ secretion and AChE activity. DUM reduced the secretion levels of Aβ42 and Aβ40 by 55% and 51%, respectively, at a concentration of 50 μg/mL. Furthermore, DUM exhibited a dose-dependent increase in sAPPα secretion and α-carboxy terminal fragment (CTF) levels at concentrations of 10 μg/mL up to 100 μg/mL. These results suggest that DUM inhibits β-secretase activity, thereby promoting the non-amyloidogenic pathway of APP metabolism at these concentrations. These results revealed that DUM inhibits β-secretase, which competitively acts on APP, sharing the same substrate with α-secretase. Based on these findings, we propose that DUM could serve as a natural resource to improve memory and cognition through β-secretase inhibition.
Keywords:
Alzheimer's disease, β-amyloid, Amyloid precursor protein, Acetylcholinesterase, Dendrotrophe umbellate (Blume) Miq.알츠하이머병(Alzheimer’s disease, AD)은 기억력 및 인지능력의 저하를 특징으로 하는 신경퇴행성질환이며 가장 흔한 형태의 치매이다.1) AD는 뇌에서 베타아밀로이드(β-amyloid; Aβ)의 올리고머화에 의한 노인반(senile plaques)을 형성하고, 미세소관 관련 단백질인 타우(p-tau)의 과인산화에 의한 신경섬유 엉킴(neurofibrillary tangles)으로 인해 신경염증이 발생하고 신경세포의 손실이 일어나게 된다.1) 국제알츠하이머병협회(ADI)에 따르면, 현재 매 3초마다 한 명이 치매에 걸리고 있으며, 2030년에는 전 세계 치매 환자 수가 7,800만 명에 이를 것으로 예상된다. 국내 치매 환자도 노령화에 따라 급증하고 있어 올해 65세 이상 치매 환자 수는 100만 명을 넘을 것으로 추정하고 있다.2)
Aβ는 아밀로이드 전구 단백질(Amyloid Precusor Protein; APP)의 분해 효소인 β-secretase와 γ-secretase의 연쇄적 절단에 의해 APP intracellular domain(AICD)을 생성하며, 이 경로를 아밀로이드 생성 경로(amyloidogenic pathway)라고 한다. 한편 비아밀로이드 생성 경로(non-amyloidogenic pathway)는 α-secretase와 γ-secretase의 연쇄적 절단으로 Aβ가 아닌 P3 단편과 AICD가 생성된다.3) 따라서 α-secretase의 기질경쟁적 효소인 β-secretase와 이 과정에 생기는 대사체인 β-CTF (β-carboxyl-terminal fragment)를 연속적으로 절단하는 γ-secretase에 의해 아밀로이드 생성경로가 활성화되어 Aβ가 증가하며, 이것이 뇌에서 응집 · 축적됨에 따라 신경독성을 나타내어 신경세포 사멸을 일으키게 된다.
최근 AD의 병리학적 마커로 Aβ와 p-tau를 표적하는 치료제를 개발하는 데 연구가 집중되고 있는데, 2021년 최초로aducanumab이 AD 치료제로 승인되었지만, 높은 ARIA (amyloid-related imaging abnormalities) 부작용 발생으로 인해 시장에서 철수되었다. 한편, 수용성 Aβ 프로토피브릴에 결합하는 인간화 IgG1 단일클론항체인Lecanemab이 임상실험에서 초기 알츠하이머 환자의 아밀로이드 수치를 감소시켰으며, 두 번째로 FDA의 승인을 받음으로써 Aβ 가설을 뒷받침하는 약물로서 인정을 받게 되었고 미국, 일본, 중국, 한국 그리고 최근 EU에서도 AD 치료제로 승인되었다. 최근에 Donanemab이 세 번째 신약으로 승인되었으며 Aβ를 표적으로 하는 AD 치료제 연구가 다양하게 진행되고 있다.4) 이외에도 아세틸콜린에스테라제(acetylcholinesterase; AChE) 억제제인 galantamine, rivastigmine, donepezil과 같은 AChE 억제 약물들이 AD 증상을 개선하는 것으로 증명되었으며,5-7) 또한 AD의 복잡한 병인에 따라, AD의 예방 및 치료제 개발을 위해 다양한 분자경로를 표적으로 한 연구가 활발히 이루어지고 있다.8)
AChE는 콜린신경계에 관여하는 중추적인 효소이며, 뇌의 주요 신경전달물질인 아세틸콜린(acetylcholine; ACh)의 가수분해를 촉매하여 콜린과 아세테이트 이온을 생성한다.12) 정상인의 경우, ACh는 일정 농도로 유지되어 신경 말단에서 시냅스로 신경 자극을 전달하지만, 치매 환자는 AChE의 활성이 높아 ACh이 감소함으로 인해 신경 자극이 전달되지 못하여 기억력 장애 및 인지능력 장애를 일으키게 된다.11) 그러나 AChE 억제제는 AD 초기 단계에 가장 효과적이며, AD가 진행되면서 amyloidogenic pathway가 작동되기 때문에 추가적 약물 사용을 필요로 한다.10) 또한, AChE 억제제는 메스꺼움, 구토, 설사, 복통, 거식증, 두통, 불면증, 근육 경련, 서맥 및 실신과 같은 여러 부작용이 있어, 부작용이 상대적으로 적은 천연물을 활용한 연구가 진행되고 있다.11)
본 연구에 사용한 Dendrotrophe umbellata (Blume) Miq.는 단향과(Santalaceae)에 속하는 두꺼운 나선형 잎을 가진 상록관목으로 5m 정도까지 자라며, 캄보디아, 라오스, 베트남, 태국, 말레이시아, 인도네시아 등에 분포한다.13)
말레이시아에서는 민간에서 Dendrotrophe 속의 식물을 발열 및 피부 사상균증을 치료하는 데 사용하며, phenolic glycosides 등의 생리활성 성분이 보고되어 있다.13,14)
본 연구에서는 APP Swedish 유전자가 과잉 발현되는 신경세포주 모델에서 D. umbellata MeOH 추출물(DUM)이 α-secretase의 활성을 증가시키고, β-secretase의 활성을 조절함으로써 Aβ의 분비를 억제하였으며, AChE 활성을 억제하였기에 그 결과를 보고하고자 한다.
재료 및 방법
세포주 - APP Swedish 유전자가 과잉 발현되는 생쥐 유래 신경 세포주인 Neuro2a (APPswe)는 5% fetal bovine serum (FBS, SERENA Europe GmbH, Brandenburg, Germany), penicillin streptomycin (P/S, Lonza, Walkersville, MD, USA), L-glutamine (GE healthcare Hycolone, Logan, UT, USA), hygromycin B (Invitrogen, Carlsbad, CA, USA)가 함유된 Dulbecco's modified eagle's medium (DMEM, Lonza, Walkersville, MD, USA)와 Opti-MEM (Gibco, Grand Island, NY, USA)의 혼합 배지에서 37℃, 5% CO2의 조건으로 배양하여 사용하였다.
시료 제조 및 시약 - Dendrotrophe umbellata MeOH 추출물(이하 DUM으로 酩함)은 2011년 6월 베트남 라오스 캄무아네주 나카이 지구에서 채집되었으며 한국생명공학연구원 국제생물소재 연구센터(Daejeon, Republic of Korea)로부터 분양받아 실험에 사용하였다. 추출방법을 간략히 기술하면 다음과 같다. 건조한 줄기를 99.9% MeOH 1 L를 가하여 초음파로 15분간 추출하고 3일 동안 2시간씩, 45°C에서 방치하였다. 추출액은 여과 후 45℃ 조건에서 감압 농축 및 진공 건조하여 추출물 총 5.14 g을 얻었다. 추출물은 일정량의 DMSO (dimethyl sulfoxide, BioLife Solutions Inc, Bothell, WA, USA)에 용해하여 실험에 사용하였다. 사용한 시약은 다음과 같다. β-secretase inhibitor Ⅳ (Calbiochem, Darmstadt, Germany), galantamine (Cayman Chemical, Ann Arbor, MI, USA), acetylcholinesterase from electrophorus electricus, protease inhibitor (Sigma-Aldrich Co., St. Louis, MO, USA), anti-human sAPPα monoclonal antibody 2B3 (Immuno-Biological Laboratories, Gunma, Japan), rabbit anti-amyloid precursor protein polyclonal antibody CT20 (Calbiochem, Darmstadt, Germany), rabbit APP369 polyclonal antibody human amyloid β (1-40), human amyloid β assay kit (IBL, Kunma, Japan), cell viability EZ-cytox assay kit (CCK-8), acetylcholinesterase assay kit (Dogen bio Co. Ltd, Seoul, Korea), easy-spinTM total RNA extraction kit (iNtRON biotechnology, Seoul, Korea), primeScriptTM RT Master Mix, TB Green ® Premix Ex TaqTM (Takara Korea Biomedical Inc., Seoul, Korea)를 사용하였다.
β-amyloid(Aβ)의 분비 억제 효과 검정 - APPswe 세포주로부터 분비되는 Aβ의 양을 측정하기 위해 sandwich ELISA를 수행하였다. 6well plate (SPL life science Inc., Pocheon, Korea)에 세포 농도가 1 × 106 cells/well이 되게 배양한 후 serum-free DMEM으로 희석한 DUM을 1, 10, 50, 100 μg/mL의 농도로 각각 24시간 동안 처리한 후 배양액을 PMSF (Phenylmethylsulfonyl fluoride)의 존재 하에 회수하여 시료로 사용하였으며 양성대조군으로 β-secretase inhibitor Ⅳ 10 μM를 사용하였다. Aβ (35-40) 특이적 monoclonal antibody 또는 Aβ (38-42) 특이적 polyclonal antibody가 각각 coating된 plate에 100 μL의 시료를 넣고 4℃에서 16시간 동안 반응시키고 7회 세척한 후, horseradish peroxidase (HRP)가 conjugation된 Aβ (11-28) 특이적 monoclonal antibody를 4℃에서 1시간 동안 반응시켰다. 다시 9회 세척한 후 tetramethyl benzidine (TMB) 기질액을 넣고 실온에서 30분 동안 반응시킨 후 정지액 100 μL를 첨가하여 450 ㎚에서 microplate reader (Model 680, Bio-Rad, Hercules, CA, USA)를 이용하여 흡광도를 측정하였다.
세포독성 분석 - EZ-cytox kit를 사용하여 DUM의 APPswe 세포주에 대한 세포독성을 측정하였다. 96 well plate (SPL life science Inc., Pocheon, Korea)에 5 × 103 cells/well이 되도록 배양한 후 DUM을 1, 10, 50, 100 μg/mL의 농도로 16시간 처리하였다. Water-soluble tetrazolium 용액 10 μL를 첨가하여 1시간 배양한 후, 450 ㎚에서 microplate reader (Model 680, Bio-Rad, Hercules, CA, USA)를 이용하여 흡광도를 측정하였다.
단백질 발현 분석 - APPswe 세포주를 6well plate (SPL life science Inc., Pocheon, Korea)에 1 × 106 cells/well이 되도록 배양한 후 serum-free DMEM으로 희석한 DUM 1, 10, 25, 50 μg/mL 또는 양성대조군인 β-secretase inhibitor Ⅳ 10 μM을 24시간 처리하였다. Protease inhibitor (GenDEPOT, Katy, TX, USA) 가 포함된 cell lysis buffer (150 mM NaCl, 50 mM Tris-HCl, pH 7.4, 0.5% sodium deoxycholate, 0.5% NP-40, 5 mM EDTA)를 넣고 초음파 분쇄하여 시료로 사용하였다. 시료 중의 단백질량을 정량하기 위해 bicinchoninic acid (BCA) protein assay reagent (Thermo Fisher Inc., San Jose, CA, USA)를 이용하여 분석하였고, 단백질 50 μg을 7% tris-glycine 또는 16.5% tris-tricine SDS-PAGE로 분리한 후, immunoblotting에 의해 APP, sAPPα, APP carboxy terminal fragment (CTF) 등의 단백질 양상을 Azure C-600 (Azure Biosystems, Dublin, CA, USA)을 이용하여 측정하였다. 3회 반복 실험으로 얻어진 단백질 밴드를 Image J software (National Institutes of Health, Bethesda, MD, USA)에 의해 정량하였다.
Total RNA의 분리 및 real-time polymerase chain reaction(qPCR) 분석 - APPswe 세포주를 6well plate (SPL life science Inc., Pocheon, Korea)에 1 × 106 cells/well이 되도록 배양한 후 serum-free DMEM으로 희석한 DUM 1, 10, 50, 100 μg/mL의 농도로 24시간 처리하였다. 배지 상등액을 제거한 후 easy-spinTM total RNA extraction kit (iNtRON biotechnology, Seoul, Korea)를 사용하여 프로토콜 메뉴얼에 따라 total RNA를 분리하였다. 분리한 RNA는 260 nm, 280 nm에서 Nanodrop ND-1000 spectrophotometer (Thermo Fisher Inc., San Jose, CA, USA)을 사용하여 흡광도를 측정하고 total RNA양을 정량하였다. 각 시료는 50 ng/μL이 되도록 sterile water (RNase free)로 희석하여 사용하였으며 희석한 RNA; 8 μl, primeScriptTM RT Master Mix (Takara Korea Biomedical Inc., Seoul, Korea); 2 μL을 넣은 반응혼합물 10 μL으로 RT-qPCR 시행 전 cDNA 합성을 진행하였다. 반응은 reverse transcription 37℃에서 15분, heat inactivation of reverse transcriptase 85℃에서 5초로 설정하여 반응시켰다.
APP의 mRNA 발현을 알아보기 위한 RT-qPCR은 PCR tube에 TB Green® Premix Ex TaqTM (Takara Korea Biomedical Inc., Seoul, Korea); 12.5 μL, 10 pmol로 희석한 primer; 1 μL, cDNA 합성 RNA; 2 μL, sterile water (RNase free); 9.5 μL를 넣어 만든 25 μL 반응혼합물로 다음 분석을 진행하였다. 반응은 initial denaturation 95℃에서 30초, denaturation 95℃에서 5초, annealing & elongation 60℃에서 30초, cycle의 반복은 40회로 설정하여 CronoSTARTM 96 Real-Time PCR System (4ch, TAKARA BIO INC., Kusatsu, Shiga, Japan)을 이용하여 분석하였다. 실험에 사용한 APP primer sequence는 forward가 TGG CCA ACA TGA TTA GTG ACC이며 reverse가 AAG ATG GCA TGA GAG CAT CGT이었다. GAPDH의 primer sequence는 forward가 AAC TTT GGC ATT GTG GAA GG이며 reverse가 GGA TGC AGG GAT GAT GTT CT이었다. Primer는 바이오니아(Bioneer, Daejeon, Korea)에 의뢰하여 제작하였다.
Acetylcholinesterase (AChE) 억제 활성 분석 - DUM의 AChE 억제 활성을 측정하기 위해 acetylcholinesterase activity colorimetric assay kit (Dogen bio Co. Ltd, Seoul, Korea)를 사용하여 측정하였다. 96 well plate에 DMSO 또는 DUM을 10, 25, 50 μg/mL의 농도로 첨가하고, acetylcholinesterase (Electrophorus electricus)를 각각 30 μL와 10 μL씩 넣은 후 reaction mixture (AChE assay buffer; 45 μL, AChE enzyme mix; 2 μL, AChE probe; 2 μL, AChE substrate; 1 μL: 1 assay 기준)를 50 μL씩 넣고 차광하여 실온에서 20분 반응 후 microplate reader (Model 680, Bio-Rad, Hercules, CA, USA)를 사용하여 570 ㎚에서 흡광도를 측정하였다. 대조 약물로 10 μM galantamine을 사용하였으며, 시료를 첨가하지 않은 대조군의 흡광도를 AChE의 활성 100%로 하여, 각 시료에 대한 억제 활성을 백분율로 3회 반복하여 분석한 후 통계 처리하였다.
통계처리 - 모든 생리활성 실험은 3회 반복 실험을 통해 mean ± standard error 값으로 나타내었다. 통계 분석은 Student’s t-test와 one-way ANOVA test (Graph Pad Prism 5 software, La Jolla, CA, USA)를 실시한 후 0.1%, 1% 및 5%의 유의수준으로 검정하였다(*p < 0.05, **p < 0.01, ***p < 0.001).
결과 및 고찰
D. umbellate MeOH 추출물(DUM)의 β-amyloid (Aβ) 분비억제 활성과 세포독성 - DUM을 농도별로 APPswe 세포주에 처리한 후 세포배양액으로 분비된 Aβ를 sandwich ELISA 방법으로 측정하였다. DMSO를 처리한 시료인 음성대조군(C)의 Aβ의 분비량(g/mL)과 비교하고 이를 백분율로 표시하였다. DUM 1, 10, 50, 또는 100 μg/mL 처리 시 Aβ1-40의 분비량은 각각 약 24±2.1, 23.8±3.7, 10.5±2.5, 3.6±0.4 ng/mL이었으며 농도 50, 100 μg/mL에서 음성대조군에 비해 Aβ1-40를 각각 약 51%, 84%의 억제활성을 보여 농도의존적으로 Aβ1-40 분비를 억제하였다(Fig. 1A, C). 또한 Aβ1-42의 분비량은 각각 약 1.2±0.1, 1.1±0.2, 0.4±0.1, 0.2±0.02 ng/mL이었으며 농도 50, 100 μg/mL에서 음성대조군에 비해 Aβ1-42를 각각 약 62%, 78% 억제하였다(Fig. 1B, C). DUM은 50, 100 μg/mL에서 농도 의존적으로 두 종의 Aβ에 대해 그 분비량을 크게 감소시켰으며 농도 100 μg/mL에서는 Aβ1-42에 대한 억제 효과보다 Aβ1-40에 대하여 더 강한 분비 억제 효과를 나타내었지만 농도 50 μg/mL에서는 Aβ1-42에 대하여 Aβ1-40 보다 약 11% 더 강한 분비 억제 효과를 나타내었다. 한편, 양성대조군으로 사용한 10 μM의 β-SI (β-secretase inhibitor IV)는 Aβ1-40 와 Aβ1-42에 대하여 각각 약 92%, 83%의 분비 억제 활성을 보였다(Fig. 1C).
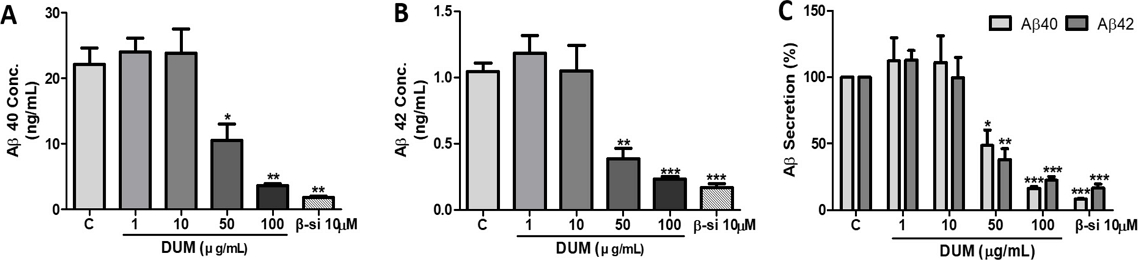
Effects of Methanol extract of Dendrotrophe umbellata on the secretion of β-amyloid. APPswe cells were treated with DMSO (C) or various concentrations (1, 10, 50, or 100 μg/mL) of the methanol extract of D. umbellate (DUM) for 24 h. The supernatant was used for Aβ40/42 ELISA. Data are presented as mean ± SE from three independent experiments. Statistical significance was assessed using one-way ANOVA test using GraphPad Prism 5 software (*p < 0.05, **p < 0.01, ***p < 0.001 compared to control cells). C: negative control (0.1% dimethyl sulfoxide [DMSO] treatment); β-si: positive control (10 μM β-secretase inhibitor); Aβ40: β-amyloid 40; Aβ42: β-amyloid 42.
DUM의 APPswe 세포주에 대한 세포독성을 분석한 결과, DUM 각각 1, 10, 25, 50, 또는 100 μg/mL 처리 세포의 생존율은 각각 대조군 처리 세포의 생존율의 96.01±2.6, 84.32±5.3, 81.38±3.5, 83.58±6.9, 64.1±2.3%를 나타내었다(Fig. 2). 50 μg/mL의 DUM은 APPswe 세포주에 대해 약 16% 세포독성을 나타내었으며, 100 μg/mL의 DUM 처리시 약 36%의 APPswe 세포주가 사멸한 반면에, Fig. 1C에서 본 바와 같이, 100 μg/mL의 DUM 처리시 Aβ1-42의 분비량은 대조군 대비 약 78%가 감소하였다. 약 36%의 APPswe 세포에 대한 독성이 Aβ1-42의 분비를 감소시킨 원인일 것이라 추측할 수 있지만, DUM은 세포독성보다 더 강한 Aβ 분비 억제 활성을 나타낸다고 판단하고 그 약리학적 기전에 대해 알아보고자 APP 단백질의 대사에 미치는 영향을 분석하였다.
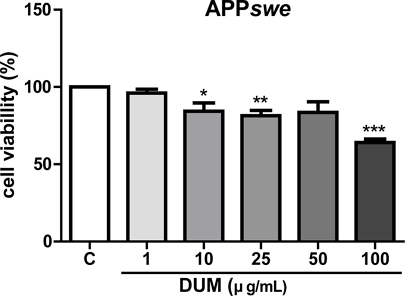
Effects of the methanol extract of Dendrotrophe umbellate on APPswe cell viability. APPswe cells were cultured at confluency in a 96-well plate and treated with various concentrations (1, 10, 25, 50, or 100 μg/mL) of the methanol extract of D. umbellate (DUM) for 24 hours. After treatment, the EZ-Cytox reagent was added to the wells, and the cells were incubated for 1 hour. Absorbance at 450 nm was measured using a microplate reader. Data are expressed as the mean ± SE from three independent experiments. Statistical significance was evaluated using one-way ANOVA in GraphPad Prism 5 software (***p < 0.001 compared to control cells). C: negative control (0.1% dimethyl sulfoxide [DMSO] treatment).
한편, Aβ1-42는 Aβ1-40에 비해 소수성이 상대적으로 커 신경 독성이 강하며 Aβ 응집 및 섬유화를 유도하기 때문에 Aβ1-42 단량체의 증가는 AD의 원인으로 알려져 있으며, 치매 환자의 진단을 위해 뇌척수액의 Aβ42/Aβ40 비율이 중요한 바이오마커로서 사용되고 있다.15,16)
D. umbellata MeOH 추출물(DUM)이 APP (amyloid precursor protein)와 관련 단백질 발현 및 mRNA 발현에 미치는 영향 - Fig. 1의 결과를 바탕으로 DUM이 Aβ의 분비를 억제하는 약리학적 기전을 규명하기 위해 DUM 1, 10, 50 또는 100 μg/mL 농도로 처리한 APPswe 세포주로부터 APP 및 그 대사체인 sAPPα의 단백질 분비 수준을 western blot 방법으로 검정하였다. APPswe 세포주의 세포 분획으로부터 APP 단백질을, 세포 배양액으로부터는 sAPPα 단백질을 추출하여 western blot 후에 Image J로 분석하였다.
Fig. 3A와 3B에 나타낸 바와 같이, DUM 1, 10, 50 또는 100 μg/mL 처리 시 APP 단백질의 발현량은 음성대조군(DMSO처리군)에 비해 각각 110.42±1, 94.36±4, 81.7±4.5, 69.17±6.2%으로 10 μg/mL의 농도부터 각각 약 6%, 18%, 31%의 단백질 발현량의 유의한 감소를 나타내었다. 이는 Fig. 2의 DUM 농도 50, 100 μg/mL의 약 16, 36%의 세포독성과 유사한 결과로, DUM의 세포독성이 APP 단백질의 발현량에 영향을 끼친 것으로 예상할 수 있다. 반면에, 세포 외로 분비된 sAPPα 단백질의 경우 DUM 1, 10, 50, 또는 100 μg/mL 처리 시 음성대조군에 비해 각각 136.85±35.8, 139.57±22.8, 188±57.5, 282.74±54.7%로 농도의존적으로 증가하였다(Fig. 3A, 3C). APP 단백질은 α-secretase에 의해 대사되어 sAPPα이 배양액으로 분비되게 되는데, 기존의 여러 보고에 따르면 APP 단백질의 대사산물인 sAPPα는 배양된 신경세포에서 다양한 세포사멸 유발 물질의 영향을 완화하는 강력한 신경보호 특성을 가지고 있으며,17,18) 이외에 신경영양, 신경생성, 시냅스 생성, 신경가소성 및 기억력 강화 특성을 가지는 것으로 보고되었다.19,20)
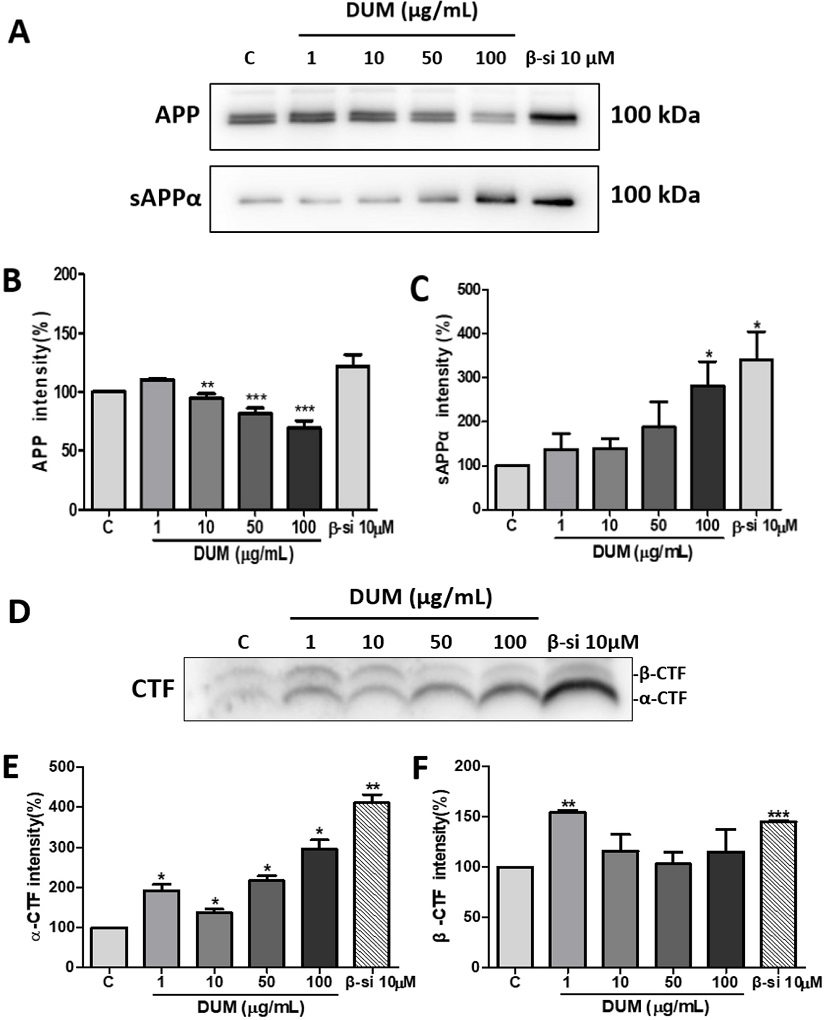
Effects of Methanol extract of Dendrotrophe umbellata on the metabolism of amyloid precursor protein. APPswe cells were treated with DMSO (C) or the methanol extract of D. umbellate (DUM) for 24 h, followed by lysis with a cell lysis buffer. The cell lysates and conditioned media were subjected to either 7% SDS-PAGE or 16.5% tris-tricine gels, and subsequently analyzed by immunoblotting. (A, C): mouse anti-sAPPα (2B3) monoclonal antibody (1:400); (A, B): rabbit anti-APP polyclonal antibody (1:10,000); (D, E, F): rabbit APP369 polyclonal antibody (1:1,000). Protein levels were quantified by normalizing their expression levels to actin using ImageJ 1.37 software. Data are presented as mean ± SE from three independent experiments. Statistical significance was assessed using one-way ANOVA in GraphPad Prism 5 software (*p < 0.05, **p < 0.01, ***p < 0.001 compared to control cells). C: control (0.1% dimethyl sulfoxide [DMSO] treatment); APP: amyloid precursor protein; sAPPα: soluble APPα; CTF-α: APP carboxy-terminal fragment α; CTF-β: APP carboxy-terminal fragment β; BACE: β-site APP cleaving enzyme.
AD 치료법 개발은 두 가지 주요한 접근 전략 방법이 있는데, 그 첫번째는 Aβ을 생성하는 분비 효소를 억제하는 방법이며 두 번째는 Aβ 응집체 형성을 직접적으로 방해하는 방법이다.21) 첫 번째 접근 방법은 α, β 또는 γ-secretase 활성을 조절하는 물질을 개발하는 것이다. α- 및 β-secretase는 APP를 절단하는 과정에서 서로 기질경쟁적으로 작용하는데, α-secretase 활성의 증가는 β-secretase 활성의 감소를 가져오며 결국 Aβ 형성을 방지한다. 따라서 대부분의 AD 증상과 관련된 신경병리학적 변화인 Aβ를 감소시키기 위해 β-secretase 활성을 표적으로 하는 전략이 AD 치료제를 개발하는 데 있어 매우 유망해졌다.22)
DUM의 α 및 β-secretase 활성에 미치는 영향을 확인하고자 농도별 DUM 처리 세포분획물을 tris-tricine gel로 분리하여 각각의 효소반응 결과물인 α-CTF와 β-CTF 단백질 발현 양상을 비교하였다. 그 결과, DUM 1, 10, 50 또는 100 μg/mL 처리 시 α-CTF 단백질양은 음성대조군에 비해 각각 192.31±15.1, 137.82±8.7, 216.8±12, 295.97±22.6%를 나타내어 유의한 단백질 발현량의 증가를 보였다(Fig. 3D, E). β-CTF 단백질은 음성대조군에 비해 각각 154.32±2.5, 115.99±16.7, 103.06±11.5, 114.94±22.5%로 1 μg/mL의 농도에서 약 54% 유의하게 단백질 발현량이 증가하였으나 이하 10, 50, 100 μg/mL의 농도에서 단백질 수준이 Control의 단백질 발현량 수준과 비슷하게 감소하는 양상을 보였다(Fig. 3D, F). 또한 농도별 DUM 처리시 α 및 β-CTF 단백질 발현량의 상대적 비율을 비교하였을 때, β-CTF 단백질의 발현량에 비해 α-CTF 단백질 발현량은 농도의존적으로 각각 약 1.26, 1.21, 2.14, 2.6배로 그 차이가 증가했다(Fig. 3D, E, F). 즉, DUM이 50 μg/mL 이상의 농도에서 β-secretase와 기질경쟁적으로 작용하는 a-secretase 활성의 증가를 유도한 것으로 보인다. 이상의 결과를 종합해보면 DUM을 50, 100 μg/mL 농도에서 세포독성을 나타내며 APP 단백질 발현량을 감소시키는 반면, 아밀로이드 대사경로에 작용하는 효소인 β-secretase의 활성을 표적하여 그 활성을 감소시키는 것으로 예상된다.
한편. 최근까지 α-secretase 활성을 증가시키며 β-secretase 활성을 조절하여 Aβ을 억제시키는 것으로 보고된 천연물 및 천연 성분으로는 인삼의 사포닌 성분인 진세노사이드 Rg1,23,24) 녹차의 폴리페놀 화합물 EGCG,25,26) Coptidis rhizome 및 Berberis vulgaris에서 추출한 이소퀴놀린 알칼로이드인 베르베린 및 Ligusticum chuanxiong에서 유래한 리구스틸리드 등이 보고되었다.27-29) 본 연구팀은 향후, DUM의 α-secretase 활성을 증가시키고 β-secretase활성을 조절하는 유효 성분을 규명하는 연구 또한 진행할 예정이다.
DUM의 24시간 약물처리가 APPswe 세포주에서 APP mRNA 발현에 미치는 영향을 확인하기 위하여 DUM을(1, 10, 50, 100 μg/mL)농도로 처리한 APPswe 세포주의 mRNA를 분리하여 RT-qPCR (Reverse transcription quantitative real-time polymerase chain reaction)을 실시하였다. 기준 유전자는 housekeeping gene인 GAPDH를 사용하였다. 그 결과 DUM 1, 10, 50, 또는 100 μg/mL 처리 시 APP mRNA 발현량은 음성대조군과 비교하여 각각 82.3±7.7, 38.8±10.8, 22.3±2.6, 19.6±6.4%을 나타냈으며 농도의존적으로 유의한 mRNA 발현량의 감소를 보였다(Fig. 4). 이는 DUM의 APPswe cell에 미치는 세포독성(Fig. 2), APP 단백질 발현량(Fig. 3A, B)의 결과와 비교하여 농도의존적인 APP 단백질 감소 양상이라는 점은 유사하나 그 감소량이 2~10배 이상이라는 상이한 결과를 보인다. 한편, mRNA에서 단백질의 합성까지는 20초에서 몇 분의 짧은 시간 간격으로 일어난다.30) 따라서 상기의 결과는 DUM이 APPswe 세포주의 APP mRNA 발현에 영향을 미치지만, 이미 번역을 거쳐 축적된 단백질의 양은 크게 감소하지 않았을 것으로 생각한다. mRNA발현량의 감소폭과 비교하여 단백질 발현량은 크게 감소하지 않은 것으로 나타났다고 추측할 수 있다(Fig. 3). 따라서 본 연구팀은 DUM이 APP mRNA 발현에 영향을 미치는 time course 가 어느 시점부터 시작되는지 면밀히 규명하기 위하여 향후 여러 개의 약물처리 시간 조건으로 RT-PCR을 진행할 예정이다.
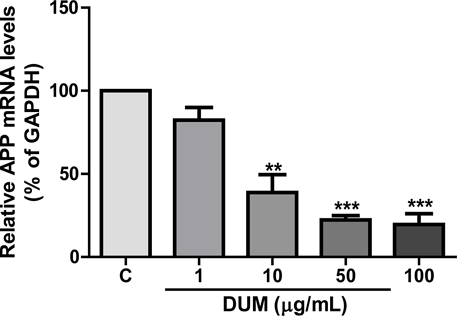
Effects of the methanol extract of Dendrotrophe umbellate on the inhibition of APP mRNA expression. APPswe cell lines were cultured in 6-well plates (SPL Life Sciences Inc., Pocheon, Korea) at a density of 1 × 106 cells/well. The cells were then treated with serum-free DMEM containing various concentrations (1, 10, 50, or 100 μg/mL) of DUM for 24 hours. Data are presented as mean ± SE from three independent experiments. Statistical significance was determined by one-way ANOVA using GraphPad Prism 5 software (**p<0.01, ***p < 0.001 compared to control cells). C: control. The primers used for real-time PCR were synthesized by Bioneer (Daejeon, Korea), with the following base sequence information: GAPDH forward: 5’ AAC TTT GGC ATT GTG GAA GG 3’ (20mer); GAPDH reverse: 5’ GGA TGC AGG GAT GAT GTT CT 3’ (20mer); APP forward: 5’ TGG CCA ACA TGA TTA GTG ACC 3’ (21mer); APP reverse: 5’ AAG ATG GCA TGA GAG CAT CGT 3’ (21mer).
D. umbellata MeOH 추출물(DUM)의 AChE (acetylcholinesterase) 억제 활성 - DUM이 AChE 활성에 미치는 영향을 확인하기 위해 DUM (10, 25 또는 50 μg/mL) 농도로 시험관 내 AChE 효소 활성을 검정하였다. 양성대조군으로 galantamine을 사용하였다. 그 결과, 음성대조군과 비교하여 각각 91.27±0.7, 44.05±1, 26.31±1.9%의 AChE 활성이 검출되었고 그 억제활성은 약 9%, 56%, 74%로, 농도의존적으로 AChE 억제 활성을 나타냈다(Fig. 5). 양성대조군인 galantamine은 10 μM 농도에서 약 61%의 억제 활성을 나타냈다. 현재 치매의 진행을 경감시키는 약물로 donepezil, galantamine 및 rivastigmine 등 AChE 억제제가 주로 사용되고 있어9) DUM의 항AChE 유효성분을 규명한다면, 새로운 AChE 억제제 개발에 기여할 것으로 생각된다. 이런 관점에서 APP 관련 효소 발현 과정을 조절하는 치료기술 개발도 모색되고 있는 바 DUM이 sAPPα의 전사 조절을 통해 치매 유발 물질인 Aβ 생성을 억제하는 연구결과는 시사하는 바가 크다고 할 수 있다.
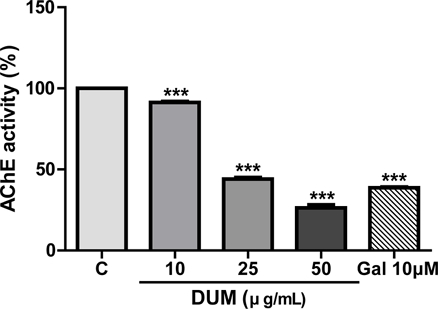
Effects of the methanol extract of Dendrotrophe umbellate on acetylcholinesterase activity. The methanol extract of D. umbellate (DUM) was prepared at final concentrations of 10, 25, or 50 μg/mL in acetylcholinesterase (AChE) assay buffer. Galantamine (10 μM) was used as the positive control. Data are expressed as mean ± SE from three independent experiments. Statistical significance was evaluated using one-way ANOVA in GraphPad Prism 5 software (***p < 0.001, compared to control cells). C: negative control (0.1% dimethyl sulfoxide [DMSO] treatment); Gal: positive control (galantamine, an acetylcholinesterase inhibitor).
결 론
DUM은 100 µg/ml 농도에서 Aβ1-42의 분비를 약 78% 감소시켰으며. 50, 100 µg/ml에서 α-secretase 활성을 증가시켜 β-secretase의 활성을 억제하였다. DUM은 50 µg/ml 농도에서 약 74%의 높은 AChE 억제 활성을 보였다. 이러한 결과를 종합해보면 D. umbellate은 Aβ 및 β-secretase, AChE를 표적으로 하는 치매 치료제 개발을 위한 후보자원으로서 개발가치가 있을 것으로 사료된다.
Acknowledgments
본 연구는 교육부와 한국연구재단의 재원으로 지원을 받아 수행된 3단계 산학연협력 선도대학 육성사업(LINC3.0)의 연구결과이며, 시료를 제공해준 KRIBB 해외생물소재센터에 감사드립니다.
References
-
Jorfi, M., Hecker, A. M and Tanzi, R. E. (2023) The neuroimmune axis of Alzheimer's disease. Genome Med. 15: 6.
[https://doi.org/10.1186/s13073-023-01155-w]

-
Rajan, K. B., Weuve, J, Barnes, L. L., McAninch, E. A., Wilson, R. S. and Evans, D. A. (2021) Population estimate of people with clinical Alzheimer's disease and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17: 1966-1975.
[https://doi.org/10.1002/alz.12362]

-
Bazzari, F. H. and Bazzari, A. H. (2022) BACE1 Inhibitors for Alzheimer's disease: the past, present and any future? Molecules 27: 8823.
[https://doi.org/10.3390/molecules27248823]

-
Cummings, J., Osse, A. M. L., Cammann, D., Powell, J. and Chen, J. (2024) Anti-amyloid monoclonal antibodies for the treatment of Alzheimer's disease. BioDrugs 38: 5-22.
[https://doi.org/10.1007/s40259-023-00633-2]

-
Dimitrova, D., Getova, D. and Saracheva, K. (2023) Effects of 3R, 16S-2-hydroxyethyl apovincaminate (HEAPO), donepezil and galantamine on learning and memory retention in naïve wistar rats. Acta Pharmaceutica 73: 91-105.
[https://doi.org/10.2478/acph-2023-0006]

-
El-Sayed, N. A., Farag, A. E., Ezzat, M. A. F., Akincioglu, H., Gülçin, İ. and Abou-Seri, S. M. (2019) Design, synthesis, in vitro and in vivo evaluation of novel pyrrolizine-based compounds with potential activity as cholinesterase inhibitors and anti-Alzheimer's agents. Bioorg. Chem. 93: 103312.
[https://doi.org/10.1016/j.bioorg.2019.103312]

-
Abdallah, A. E. (2024) Review on anti-alzheimer drug development: approaches, challenges and perspectives. RSC Adv. 14: 11057-11088.
[https://doi.org/10.1039/D3RA08333K]

-
Benek, O., Korabecny, J. and Soukup, O. (2020) A Perspective on multi-target drugs for Alzheimer's disease. Trends Pharmacol. Sci. 41: 434-445.
[https://doi.org/10.1016/j.tips.2020.04.008]

-
Birks, J. (2006) Cholinesterase inhibitors for Alzheimer's disease. Cochrane Database Syst. Rev. 2006: CD005593.
[https://doi.org/10.1002/14651858.CD005593]

-
Jadhav, D., Saraswat, N., Vyawahare, N. and Shirode, D (2024) Targeting the molecular web of Alzheimer’s disease: unveiling pathways for effective pharmacotherapy. Egypt. J. Neurol. Psychiatry Neurosurg. 60: 7.
[https://doi.org/10.1186/s41983-023-00775-8]

-
Moreta, M. P., Burgos-Alonso, N., Torrecilla, M., Marco-Contelles, J. and Bruzos-Cidón, C. (2021) Efficacy of acetylcholinesterase inhibitors on cognitive function in Alzheimer's disease. Biomedicines 9: 1689.
[https://doi.org/10.3390/biomedicines9111689]

-
Conti Filho, C. E., Loss, L. B., Marcolongo-Pereira, C., Rossoni Junior, J. V., Barcelos, R. M., Chiarelli-Neto, O., da Silva, B. S., Passamani Ambrosio, R., Castro, F. C. A. Q., Teixeira, S. F. and Mezzomo, N. J. (2023) Advances in Alzheimer's disease's pharmacological treatment. Front Pharmacol. 14: 1101452.
[https://doi.org/10.3389/fphar.2023.1101452]

-
Wiart, C. (2021) Medicinal plants in the Asia Pacific for zoonotic pandemics, Volume 3: family Bixaceae to Portulacaceae, p181, Boca Raton, USA.
[https://doi.org/10.1201/9781003180371]

-
Hou, X., Sun, M., Gao, H., Cui, y. and Xiao, K. (2013) Chemical constituents from the stems of Dendrotrophe frutescens. Biochemical Systematics and Ecology 51: 156-159.
[https://doi.org/10.1016/j.bse.2013.08.022]

-
Coimbra, J. R. M., Marques, D. F. F., Baptista, S. J., Pereira, C. M. F., Moreira, P. I., Dinis, T. C. P., Santos, A. E. and Salvador, J. A. R. (2018) Highlights in BACE1 inhibitors for Alzheimer’s disease treatment. Front. Chem. 6: 178.
[https://doi.org/10.3389/fchem.2018.00178]

-
Baldeiras, I., Santana, I., Leitao, M. J., Gens, H., Pascoal, R., Tabuas-Pereira, M., Beato-Coelho, J., Duro, D., Almeida, M. R. and Oliveira, C. R. (2018) Addition of the Aβ42/40 ratio to the cerebrospinal fluid biomarker profile increases the predictive value for underlying Alzheimer’s disease dementia in mild cognitive impairment. Alzheimer's Research & Therapy 10: 33.
[https://doi.org/10.1186/s13195-018-0362-2]

-
Mattson, M. P., Cheng, B., Culwell, A. R., Esch, F. S., Lieberburg, I. and Rydel, R. E., (1993) Evidence for excitoprotective and intraneuronal calcium-regulating roles for secreted forms of the beta-amyloid precursor protein. Neuron 10: 243-254.
[https://doi.org/10.1016/0896-6273(93)90315-I]

-
Furukawa, K., Sopher, B. L., Rydel, R. E., Begley, J. G., Pham, D. G., Martin, G. M., Fox, M. and Mattson, M. P. (1996) Increased activity-regulating and neuroprotective efficacy of alpha-secretase-derived secreted amyloid precursor protein conferred by a C-terminal heparin-binding domain. J. Neurochem. 67: 1882-1896.
[https://doi.org/10.1046/j.1471-4159.1996.67051882.x]

-
Mockett, B. G., Richter, M., Abraham, W. C. and Müller, U. C. (2017) Therapeutic potential of secreted amyloid precursor protein APPsα. Front. Mol. Neurosci. 10: 30.
[https://doi.org/10.3389/fnmol.2017.00030]

-
Dar, N. J. and Glazner, G. W. (2020) Deciphering the neuroprotective and neurogenic potential of soluble amyloid precursor protein alpha (sAPPα). Cell. Mol. Life. Sci. 77: 2315-2330.
[https://doi.org/10.1007/s00018-019-03404-x]

-
Lee, J. H., Ahn, N. H., Choi, S. B., Kwon, Y. and Yang, S. H. (2021) Natural products targeting amyloid beta in Alzheimer’s disease. Int. J. Mol. Sci. 22: 2341.
[https://doi.org/10.3390/ijms22052341]

-
Tyler, S. J., Dawbarn, D., Wilcock, G. K. and Allen, S. J. (2002) Alpha- and beta-secretase: profound changes in Alzheimer’s disease. Biochem. Biophys. Res. Commun. 299: 373–376.
[https://doi.org/10.1016/S0006-291X(02)02635-9]

-
Li, F., Wu, X., Li, J. and Niu, Q. (2016) Ginsenoside Rg1 ameliorates hippocampal long-term potentiation and memory in an Alzheimer’s disease model. Mol. Med. Rep. 13: 4904–4910.
[https://doi.org/10.3892/mmr.2016.5103]

-
Fang, F., Chen, X., Huang, T., Lue, L. F., Luddy, J. S. and Yan, S. S. (2012) Multi-faced neuroprotective effects of ginsenoside Rg1 in an Alzheimer mouse model. Biochim. Biophys. Acta 1822: 286–292.
[https://doi.org/10.1016/j.bbadis.2011.10.004]

-
Smith, A., Giunta, B., Bickford, P. C., Fountain, M., Tan, J. and Shytle, R. D. (2010) Nanolipidic particles improve the bioavailability and alpha-secretase inducing ability of epigallocatechin-3-gallate (EGCG) for the treatment of Alzheimer’s disease. Int. J. Pharm. 389: 207–212.
[https://doi.org/10.1016/j.ijpharm.2010.01.012]

-
Jeon, S. Y., Bae, K., Seong, Y. H. and Song, K. S. (2003) Green tea catechins as a BACE1 (beta-secretase) inhibitor. Bioorg. Med. Chem. Lett. 13: 3905–3908.
[https://doi.org/10.1016/j.bmcl.2003.09.018]

-
Cai, Z., Wang, C., He, W. and Chen, Y. (2018) Berberine alleviates amyloid-beta pathology in the brain of APP/PS1 transgenic mice via inhibiting beta/gamma-secretases activity and enhancing alpha-secretases. Curr. Alzheimer Res. 15: 1045–1052.
[https://doi.org/10.2174/1567205015666180702105740]

-
Xu, Y. J., Mei, Y., Qu, Z. L., Zhang, S. J., Zhao, W., Fang, J. S., Wu, J., Yang, C., Liu, S. J., Fang, Y., Wang, Q. and Zhang, Y. B. (2018) Ligustilide ameliorates memory deficiency in APP/PS1 transgenic mice via restoring mitochondrial dysfunction. Biomed. Res. Int. 2018: 4606752.
[https://doi.org/10.1155/2018/4606752]

-
Chen, X., Drew, J., Berney, W. and Lei, W. (2021) Neuroprotective natural products for Alzheimer's disease. Cells 10: 1309.
[https://doi.org/10.3390/cells10061309]

- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K. and Walter, P. (2002) Molecular biology of the cell, p833, Garland Science, New York.