식물 근권계에서 유래된 Streptomyces sp.의 균주 배양액과 배양액에서 분리한 이차대사물질들의 항균 활성
Abstract
Due to the intensive research for about 50 years from the early 1900s, the period from the 1940s, to the 1960s was considered the golden age of development of the antibiotics. However, from the last two decades, there has been no innovation in the development of antibiotics. One possible explanation is the vast majority of easily accessible terrestrial bacteria has been researched. Nevertheless, with advancements in scientific technology, research is progressing by studying terrestrial and marine samples that were previously inaccessible or by awakening dormant genes in previously obtained strains. However, these methods have not led to the development of antibiotics with new mechanisms. In this paper, we aim to present the potential of Streptomyces species, belonging to the phylum Actinomycetota, as a promising source for discovering antimicrobial compounds by summarizing studies that report their antimicrobial activity among strains derived from the plant rhizosphere.
Keywords:
Actinomycete, Streptomyces, Rhizobacteria, Rhizosphere, Antibiotics서론
1928년 최초의 항생제인 페니실린(penicillin)이 페니실리움(Penicillium) 속에 속하는 푸른 곰팡이에서 발견된 이후 다수의 항생제가 미국 식품의약국(U.S. Food and Drug Administration)과 유럽 의약품 감독국(European Medicines Agency)에 의해 승인되었고, 이것은 세균성 감염을 치료하는데 사용되어 인류를 여러 감염병으로부터 보호하는 중요한 수단이었다.1) 하지만 항생제의 남용과 오용이 만연하면서 세균들은 항생제에 대한 내성을 갖도록 진화한 경우가 많이 보고되었고2) 이로 인해 기존의 항생제로는 치료할 수 없는 감염병이 증가하는 추세이다3) 항생제 내성은 수술 후 감염 관리나 암 치료과정에서 특히 위험성이 높다.4)
2012년도부터 2022년까지 들어서 미국 식품의약국과 유럽의 의약품 감독국에 의해 승인받은 항생제의 수는 총 22개에 불과하다.5) 매년 수십개의 의약품이 미국 식품의약국에 의해 승인됨을 고려할 때, 이 수는 매우 적다고 할 수 있으며, 새로운 작용기전을 갖는 항생제의 개발의 중요성은 이루 말 할 수 없다.6) 또한 메티실린 내성 황색포도알균(methicillinresistant Staphylococcus aureus, MRSA) 등 기존의 항생제에 내성을 갖는 병원균들의 등장으로 인해 항생제의 발견의 중요성은 더욱 부각되고 있다.7) 약 50,000개 이상의 미생물 유래 천연물이 발견되었고 약의 개발에서 중요한 역할을 해왔다. 이들 대부분이 육상 유래 미생물이었으나, 약 50년간의 집중적인 연구로 인해 새로운 모핵의 발견과 개발은 지난 1980년대부터 급감했다.8,9)
현대 과학 기술의 발달에 따라, 접근이 불가능했던 심해를 비롯한 다양한 특이환경에서도 시료를 채집하여 연구가 이루어지기 시작했으며, 남극과 북극 같은 극지방의 시료도 채취가 가능해졌고, 이에 따라 과학자들의 연구대상으로서의 관심을 끌기 시작했다.10) 하지만 이러한 낮은 온도에서 채집된 시료의 경우 그 배양조건에서 온도가 낮은 경우가 많아 배양 시간이 오래걸리거나, 원인 모를 이유로 인해 배양이 되지 않는 경우가 많은 등의 어려움이 있다.10) 반면에 접근성이 뛰어난 육상에서는 식물의 근권계에 서식하는 균류에 대해 식물의 생장과 관련된 연구가 주를 이루어 왔다. 이들을 식물생장 촉진 근권계균(plant growth-promoting rhizobacteria, PGPR)이라고 한다. 또한 메타게놈 분석 기술의 발달로 분석에 필요한 비용과 시간이 감소하여 이러한 식물근권계에 어떤 균류들이 분포하는지를 연구한 논문들도 발표되고 있다.11) 하지만 이러한 식물근권계에서 항균 혹은 항진균 활성을 연구하여 논문으로 발표된 수는 조금씩 늘어가고 있는 추세이지만 식물생장 촉진 관련 논문의 수에 비하면 여전히 현저히 적은편이다. 본 종설 논문은 근권계 토양에서 분리된 Streptomyces 속의 항균 활성에 대한 연구로 보고된 최초의 논문이다.
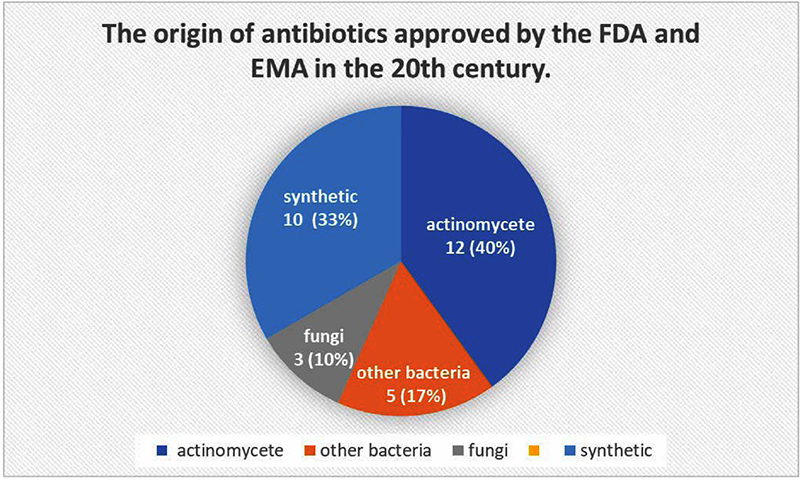
항생제와 스트렙토미세스 속 Antibiotics and Streptomyces genus–20세기까지 보고된 천연물에서 유래한 항생제의 수는 30개이며, 방선균 목에서 12개가 승인되어 40%를 차지하였으며, 특히 그 중에서도 Streptomyces 속이 10개를 차지하여 중요한 비중을 차지했다(Fig. 1).12-14) 진균을 포함한 다른 종류의 미생물에서 8개가 승인되었고 이 수를 제외한 10개가 합성 물질로부터 승인되었다. Streptomyces 속(genus)은 항생제의 주요한 원천(main source)중 하나인 방선균목(Actinomycetota phylum)에서 가장 큰 속(genus)이자 Streptomycetaceae과(family)의 기준 속(type genus)이다.15)
최초의 항생제는 arsphenamine 합성 항생제 살바르산(alvarsan)으로 1907년에 발견되어 1910년부터 임상에 사용되었으나 비소를 포함하여 독성과 안정성 문제로 인해 지금은 임상에서 사용되지 않고 있다.16) 이후 1928년 푸른곰팡이가 발견되었으나 1945년에 약으로 사용되기전까지는 1932년에 합성된 설폰아마이드가 1936년까지 살바르산을 대체하였다.17) 설폰아마이드는 오늘날까지도 임상에서 쓰이는 진정한 항생효과가 있는 첫번째 항생제이나, 페니실린이 그 역할을 많이 대체하였다.18) 또한 이러한 약들이 발견되기 전에 1890년도에 Emmenrich와 Low는 Pseudomonas aeruginosa (Bacillus pycyaneus)의 추출물을 pyocyanase로 명명하였고 이것은 여러 병원균에 활성을 나타내었다. 이러한 여러 균주들에서의 항생물질들의 발견은 1930년대 후반에 Waksman이 토양에서 살고 있는 실모양의 방선균 목이 항생물질의 주요한 원천으로서 중요하다고 정의했다.19) Waksman은 이러한 토양에서 분리된 방선균 목에서 neomycin과 결핵의 1차 치료제로 사용되는 streptomycin을 포함하는 여러 항생제들을 분리했다.20,21)
1945년에는 항생제들 중에서 가장 중요한 계열 중 하나인 테트라사이클린 계열(tetracycline class)의 항생제가 Streptomyces aureofaciens 균주에서 분리되었는데 이 물질은 금색을 띄어서 aureomycin으로 처음에 명명되었으나, 오늘날에는 chlortetracycline으로 알려져 있다.22) 이 항생제는 1948년에 그람 양성균과 음성균 모두에게 넓은 항생효과를 나타냄으로써 임상 사용이 승인되었다.23) 이어서 화이자에서 oxytetracyclin을 Streptomyces rimosus로부터, 그리고 tetracyclin을 Stretpomyces aureofaciens로부터 분리하였다.24) 이처럼 방선균 목은 20세기에 가장 많은 수의 항생제의 기원이며 항생제의 개발에서 중요한 역할을 해왔다.
본 종설논문에서는 식물근권계에서 유래한 Streptomyces sp. 균주들로부터 얻어진 추출물 혹은 이차대사물질들에서 순수분리된 물질들로부터 항균(anti-bacterial) 활성을 요약하였다.
Rhizobacteria(근권계균)–식물의 뿌리 부분에 기생 혹은 공생하는 균들을 근권계균(hizobacteria)이라 한다. 일반적으로 공생관계를 형성하려는 경우가 많으며, 식물 생장촉진 근권계균으로도 많이 불린다. 이 용어는 1970년대 후반 Joseph W. Kloepper에 의해 처음 사용되었으며 과학 문헌에서도 일반적으로 사용된다.25) 이처럼 근권계균에 대한 연구는 70년 전부터 식물의 성장 촉진 및 병충해로부터의 보호를 목적으로 많이 이루어져 왔다.26) 일반적으로 근권계균의 약 2~5% 정도가 이러한 식물생장촉진 근권계균으로 알려져 있다.25) 하지만 이러한 근권계균의 이차대사물질 혹은 추출물의 약리학적 효과에 대한 연구는 식물의 연구에 가려져 많은 연구자들의 이목을 끌지 못하였다. 논문을 작성중인 현재 시점(2025년 2월)까지 약 11570개의 영어로 발행된 논문이 Sci-finder에서 검색되며, 대부분이 식물생장촉진 근권계균에 관련된 내용이다.
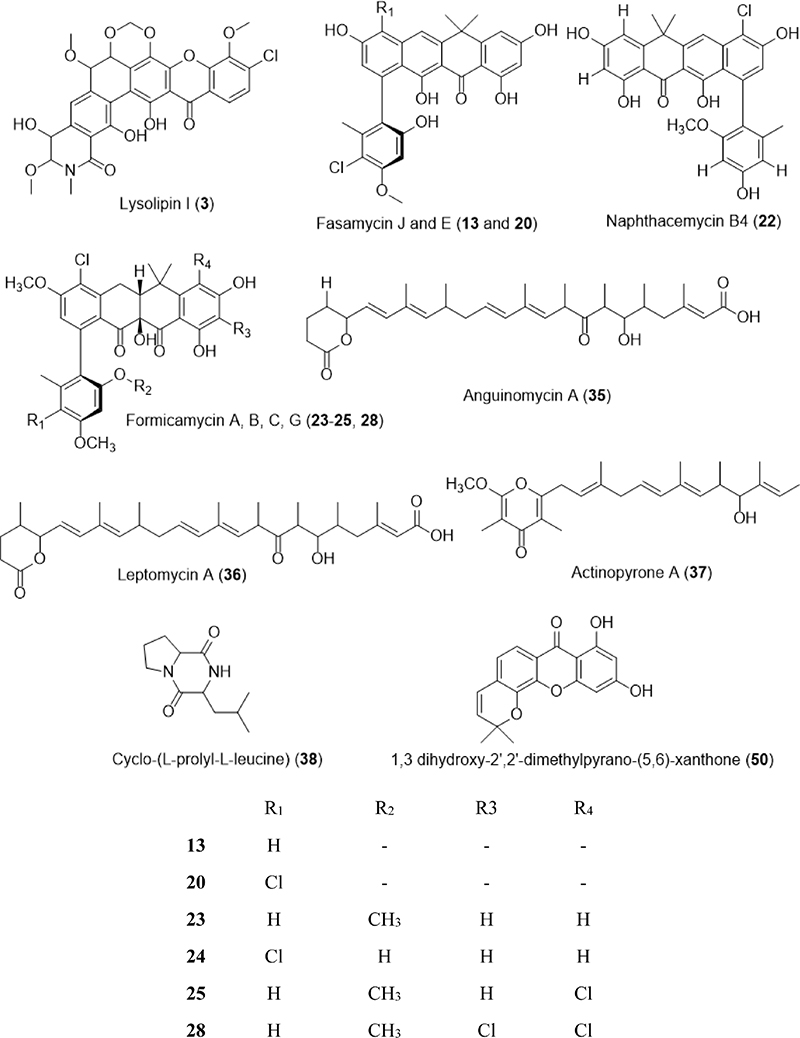
Key chemical structures and MIC (μg/ml) or disc diffusion (mm) of secondary metabolites originated from Streptomyces sp. which was isolated from rhizosphere soils.
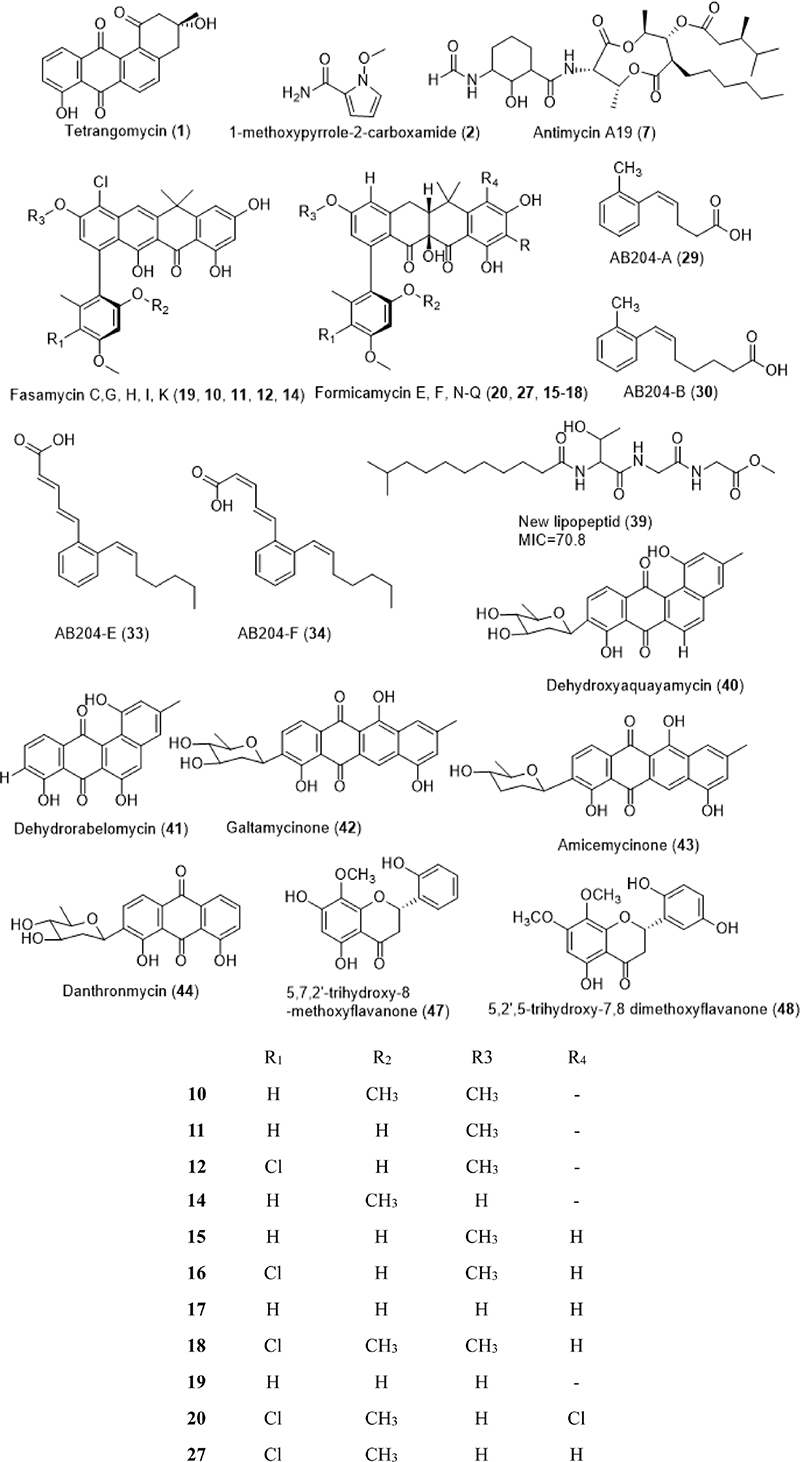
Chemical structures and MIC (μg/ml) or disc diffusion (mm) of secondary metabolites with moderated activity, originated from Streptomyces sp. which was isolated from rhizosphere soils.
하지만 최근 과학기술의 발달함에 따라, 유전자 기술 역시 상당한 진보를 이루면서 유전자의 크기가 작은 균에 대한 연구가 늘어남에 따라, 근권계균에 대한 연구는 늘어가는 추세이다. 그럼에도 불구하고 근권계균에 대한 연구는 식물생장촉진 근권계균에 집중되어 있어 항생제의 발견을 위한 연구가 필요하다고 사료된다.
Rhizospheric Streptomyces sp. with anti-microbial activity–농업을 위한 항균 활성효과를 나타내는 식물 근권계균에 대한 종설 논문은 존재하지만,27) 근권계 토양에서 분리된 Streptomyces 속의 항균 활성에 대한 연구로 보고된 종설논문은 본 논문이 최초이다.
식물 근권계에서 분리된 Streptomyces sp.에서 최초의 항균 활성을 보고한 논문은 2000년도에 불가리아에서 발표되었다.28) 비파나무(Eriobotrya japonica)의 근권계에서 분리된 균주들의 83.07%가 Streptomyces sp.로 우점종이며, 전체 균주들의 46.90%는 Bacillus subtilis ATCC6633에, 25.00%의 균주는 대장균(Escherichia coli)에, 24.40%는 병원성 효모균 (Candida utilis)에 항균활성을 나타내었다. 이 논문에서는 우점종으로 표기되어 있으나 정확한 Streptomyces sp.가 얼마나 항균 활성이 있는지를 나타냄에 있어서는 다소 모호한 부분이 있다.
2004년 미국 워싱턴주 칼로투스(Kahlotus) 도시에서 채취된 균주들 중 Streptomyces sp.가 속하는 방선균 균주가 153개가 분리되었고, 그 중 38개(24.8%)의 균주가 항균활성을 나타내었다.29) 다만 이 논문 역시 153개의 방선균 중 53개는 벌크 흙(bulk soil)에서 분리되었고 나머지 100개는 산쑥(sage brush, Artemisia tridentata)의 근권계에서 분리되었는데, 방선균 중 Streptomyces sp.가 얼마나 존재하는지에 대한 언급은 존재하지 않았다. 하지만 항진균(anti-fungal activity) 활성 효과를 갖는 모든 균주는 16s rRNA 염기서열분석을 통해 모두 Streptomyces sp. 균주에 속한다고 보고되었다.
2005년 이란의 동남부 도시 케르만(Kerman, Iran)의 과수원과 채소밭 그리고 초원에서 약 20 cm의 깊이에서 얻어진 토양들에서 분리된 근권계균들 중 Erwinia carotovora subsp.에 항균 활성을 나타내는 방선균 Streptomyces pilcatus에 관련된 논문이 발표되었다.30) 이 논문은 근권계에서 분리된 Streptomyces sp.가 특정 균주에 대한 활성을 나타냄을 보고한 최초의 논문이다. 최저성장저해농도(minimum inhibitory concentration, MIC)는 5 mg/ml-1로 보고되었으며, 배양액을 어떠한 종류의 용매로 추출했는지에 따라 활성을 표기하여 정리하였으나, 어떠한 화합물이 이러한 활성을 나타내는지에 대해서는 언급하지 않았다.
2011년에는 중국 광저우의 토마토 농장에서 얻어진 토양에서 분리한 근권계균 Streptomyces caerruleatus sp.로부터 고초균(Bacillus subtilis), 마이크로코쿠스 루테우스(Micrococcus luteus) 그리고 황색포도상구균(Staphylococcus aureus)에 대한 항균 활성이 보고되었다.31)
다음해인 2012년도에는 전라남도 담양에서 채집한 조릿대(Sasa borealis)가 서식하는 토양에서 분리한 균주 Streptomyces gramineus sp.는 Xanthomonas campestris LMG 568T 그리고 Xanthomonas axonopodis pv. vesicatoria LMG 905에 대한 항균 활성이 보고되었다.32)
2013년도에는 우크라이나의 사일레츠 마을(Silets, Lvivska region, Ukraine) 인근의 폐탄광에서 자라는 은자작나무 (Betula pendula)의 근권계에서 다섯개의 방선균이 보고되었다.33) 4개의 균주는 Streptomyces sp.로써 16s rRNA 유전자 분석을 통해 99%의 일치도를 나타냄을 확인해 각각 LV42-1 (Streptomyces galbus AQK43), LV42-2 (Streptomyces espinosus NRRL5729), LV42-3 (Streptomyces beijangensis TA13), LV42-4 (Streptomyces parvus MJM10108)로 동정하였다. 이 균주들은 Bacillus cereus, Bacillus subtilis, Micrococcus luteus, Staphylcoccus albus, 그리고 Staphylococcus aureus에 대해서 항균 활성을 나타내었다.
방콕의 까셋삿대학교의 주 캠퍼스(Kasetsart University main campus, Khan province, Thailand)와 프라츄압 키리 칸 지역에서(Prachuap Khiri Khan province, Thailand) 2005년부터 그 다음년도까지 콩과의 식물의 뿌리와 그 뿌리가 자란 토양이 채취되었다.34) 이 시료들에서부터 총 316개의 방선균을 분리하였고 콩에 유해한 병원균인 Xanthomonas campestris pv. Glycine을 억제하는지 그 활성을 테스트하였고, 64개의 균주가 활성을 나타내었으며 이것은 20.2%에 해당하며 기존에 보고된 논문보다 높은 수치이다. 또한 방선균 균주들의 83%가 Streptomyces sp.로 확인되었다.
2015년 광주의 북구 용봉동의 대나무의 근권계균을 분리하였다.35) 이 근권계균은 16S rRNA 유전자 서열분석에 의해 Streptomyces albosporeus subsp.와 가장 높은 일치도(97.9%)를 보였고, Streptomyces bambusae sp. nov로 명명되었다. 이 균주는 Bacillus subtilis KEMB 51201-001, Staphylococcus aureus KEMB 4659, Pseudomonas aeruginosa KACC 10185, P. larvae KACC 14031, Escherichia coli KEMB 212-234, C. albicans KACC 30003 그리고 A. niger KACC 40280에 대해 항균활성을 나타낸다고 보고되었다.
2016년에는 국화과에 속하는 Achillea ketenoglui의 근권계에서 분리한 기지 물질 tetrangomycin (1)의 항균 및 항진균 활성이 논문으로 발표되었다.36) 이 균주 역시 16S rRNA 유전자 분석을 통해 분석되어 Streptomyces stramineus와 99%의 높은 유사도를 나타내었고 Streptomyces sp. CAH29로 명명되었다. 이 균주에서 분리된 tetrangomycin과 이 균주의 헥산(hexane) 추출물, 에틸아세테이트(ethyl-acetate, EtOAc) 추출물 그리고 다이클로로메테인(dichloromethane, DCM)은 각각 Escherichia coli (ATCC 25922), Staphylococcus aureus (ATCC 25923), Streptococcus pyogenes (ATCC 19615), Pseudomonas aeruginosa (ATCC 27853), Candida albicans (ATCC 10231), methicillin resistant Staphylococcus. aureus (MRSA, clinical isolate), vancomycin resistant Enterococcus (VRE, clinical isolate) 그리고 Candida albicans (clinical isolate)에 대해 저해활성이 평가되었다.
2017년도에는 식물근권계균에서 분리된 최초의 단일 신규화합물이 항균활성을 갖는다고 보고되었는데, 바로 파라고무나무(Hevea brasiliensi)의 근권계균에서 분리된 Streptomyces griseocarneus SWW368 균주의 배양액에서 얻어진 파이롤(pyrrole) 계열 화합물 1-methoxypyrrole-2-carboxamide (2)로 3개의 균주에 대해 저해활성을 나타내었다.37) 태국의 뜨랑 주(Trang province, Thailand)의 과수원에서 얻어진 근권계균 Streptomyces griseocarneus SWW388은 16s rRNA 유전자 분석을 통해서 Streptomyces griseocarneus DSM40004T와 99.45%의 유사도를 보이는 것으로 나타났고, 물질 2는 그람 양성균인 Staphylococcus aureus KB210 (ATCC6538p), Kocuria rhizophila KB212 (ATCC9341) 그리고 그람 음성균 Xanthomonas smegmatis KB42 (ATCC607) 균주에 대해 저해활성을 나타내었다.
2017년도에는 식물근권계에서 분리한 Streptomyces sp.에서 항균활성을 갖는 논문이 2편이 더 발행되었는데, 인도의 피너스 나무(pinus tree)의 근권계에서 분리된 균주 Streptomyces collinus DPR20의 배양액 추출물과 인도의 근권계에서 분리되었다고만 보고된 균주 Streptomyces flavofuscus ARITM02에서 분리된 색소로부터 항균 활성이 보고되었다.38,39) 2018년도 브라질의 카팅가 생물군계(Brazil, Caatinga)에서 얻어진 근권계에서 분리한 120개의 방선균들을 세계적으로 감귤류 과일(citrus)에 세균성 병원균으로 잘 알려진 Xanthomonas citri subsp. Citri에 대해 억제활성을 실험하였다.40) 그 중 Streptomyces Caat 1-54 균주가 가장 뛰어난 억제 활성을 나타내었으며 LC-MS/MS 분석을 통해서 lysolipin I (3)과 lysolipin X (4)를 주요 활성물질임을 확인하였다.
중국의 신장 지역의 타림강(Tarim, Xinjiang) 인근에서 1년과 3년생인 건강한 감초(Glycyrrhiza inflata Bat)를 무작위 선별하여 껍질, 뿌리, 줄기 그리고 잎을 마지막으로 행군 물을 배양하여 균주를 분리하였다.41) 이 감초들에서 총 23개의 Streptomyces sp. 균주를 분리하였고 이 균주들은 항균활성 평가가 이루어진 대부분의 균에 대해 억제활성을 나타내었다. 튀니지의 EI Montazah 공원(Tunis, Tunisia)에서 채집된 식물 라벤더(Lavandula officinalis)의 근권계 토양에서 Streptomyces sp.에 속하는 균주 S2T를 분리하였고 이 균주의 추출물은 Staphylococcus aureus ATCC25923, Escherichia coli ATCC 35218 그리고 Bacillus cereus ATCC 14759에 대해 억제 활성을 보였다.42) Cassava (Manihot esculenta Crantz) 근권계 토양을 중국 하이난 지역의 하이커우 도시(Haikou city, Hainan Province)에서 채집하였고 총 63개의 방선균 목에 속하는 균주를 분리하였다.43) 이중 14개의 Streptomyces 속에 속하는 균주는 항균활성이 시행된 8개의 균주에 대해 모두 억제 활성을 나타내었다. 모로칸에서 얻어진 식물근권계균을 포함하는 식물 연관 시료와 토양에서 분리된 균주들 중 480개가 방선균 목에 속했으며, 기회감염성 감염을 대응하기 위해 non-pooplyenic 항진균 활성 균주를 선별하기 위한 억제능력 평가를 진행하였고, 가장 뛰어난 균주는 방선균 목 내의 Streptomyces 속에 속했다.44) 이 균주는 Streptomyces Z26으로 명명되었으며 LC-MS와 NMR 분석을 통해서 신규 물질 Novonestmycin A (5) 와 B (6)로 결정되었다. 이 두 물질들은 Streptomyces sp. RS-28 균주에서 생산된 liposidolide A와 비슷한 구조를 갖고 있다.45) 또 비슷한 구조로는 brasinolide A가 있는데, Aspergillus niger에 대해 보통의 억제활성을 나타낸다고 보고되었다.46) 같은 연구진이 18년도에 모로칸의 장미 빛 가시(Alyssum spinosum)의 근권계에서 분리한 균주 Streptomyces AS25로부터 non-polyneic 항진균 활성을 확인하였고 순수화합물 antimycin A19 (7)를 발견하였다.47) 2019년도에는 사우디 아라비아의 Dawadmi governorate, Riyadh province에서 얻어진 근권계 토양에서 Streptomyces DW102를 분리하였다.48) 이 균주는 다양한 약물저항 균주들에 대해 억제활성을 나타내었다. 인도의 첸나이네 벨라체리에서 채집된 베틀 후추의 근권계 토양에서 분리된 방선균 Streptomyces species strain KAV2가 분리되었고 포도상알균을 포함한 6개의 균주에 대해 억제활성을 나타내었다.49) 홍콩의 마이포 맹그로브 자연보호구역에 서식하는 식물 홀리잎 아칸서스(holly-leaved acanthus, Acanthus ilicifolius)의 근권계 토양에서 분리한 113개의 균주중에서 14개의 균주가 Streptomyces 속에 속했으며 이 중 10개의 균주는 진균을 포함한 여러 균에 대하여 억제능을 나타내었다.50)
중국 윈난성 원산지역(Wenshan region, Yunnan rovince)에서 삼칠삼 또는 전칠삼(Panax notoginseng)으로 불리는 식물의 근권계 토양에서 42개의 Streptomyces 속에 속하는 균주 42개를 분리하였다. 이 균주들은 S. aureus 등에 활성억제능을 보였다.51)
에델바이스(edelweiss, 국화과에 속하는 고산식물, Leontopodium nivale subsp. alpinum(Cass.) Greuter의 근권계 토양에서 분리된 균주 Streptomyces sp. S4.7 균주로부터 Viennamycin A (8)와 B (9)를 분리하였다.52) 이 물질들은 그람음성균과 진균을 포함하는 여러 균주에 대해 억제활성을 나타내었다.
튀르키예의 발리케시르(Balikesir, Turkey)에서 서식하는 4종류의 올리브 나무(olive tree)의 근권계 토양 시료에서 Streptomyces sp.균주 11개가 분리되었다.53) 이 균주들은 약 30개의 균주에 대해 활성테스트가 이루어졌다.
Polyalthia cerasoides 또는 Uberantha cerasoides로 알려진 커스터드 애플과(Annonaceae family)에 속하는 식물의 근권계 토양에서 균주 Streptomyces sp. KIB-1414가 분리되었다.54) 이 균주에서 신규물질들 fasamycins G-K (10-14)과 formicamycins N-Q (15-18) 그리고 10개의 기지물질 fasamycin C (19)와 E (20), 7-(2,4 dimethoxy-6-methylphenyl)-2,4,6-trihydroxy-9-methoxy 12,12-dimethyltetracen-5(12H)-one (21), naphthacemycin B4 (22), formicamycin A-C (23-25), E-G (26-28)가 분리되었다. 이 물질들은 MRSA, S. aureus, B. substilis 그리고 E. coli에 대해 활성을 나타내었다. 이 물질들 중 formicamycin G (28)는 MRSA 균주에 대해 0.20 μg/ml의 MIC를 나타내어, 양성 대조군로 사용된 반코마이신(vancomycin, 1.56 μg/ml) 보다 우수한 활성을 보였다. 나머지 3개의 균주에 대해서는 각각 0.39, 0.39, 0.78 μg/ml의 MIC를 보였으며, 이것은 양성 대조군으로 사용된 물질 카나마이신(kanamycin)의 MIC 1.56, 0.78, 50.00 μg/ml 보다 우수한 활성을 나타내었다. 태국의 치앙마이에 위치한 치앙마이 대학교의 기름야자나무 농장에서 얻어진 기름야자나무의 근권계에서 균주 Streptomyces palmae CMU-AB204T가 분리되었다.55) 이 균주에서는 AB204-A부터 AB204-F (29-34)로 명명된 6개의 신규 phenyl alkenoic acids와 3개의 기지물질 anguinomycin A (35), leptomycin A (36), actinopyrone A (37)을 분리했다. 이 물질들은 S. aureus, B. subtilis 등의 균에 억제활성이 있는 것으로 보고되었다. 튀니지의 남쪽(Tunisia)의 오아시스에서 서식하는 대추야자의 근권계 토양에서 균주 Streptomyces misionensis V16R3Y1이 분리되었다.56) GC-MS를 통한 분석에서 항균활성을 갖는 cyclo-(L-prolyl-L-leucine) (38)이 확인되었으며, 분획물 단계에서 통한 15개의 균주에 대한 항균활성도 평가되었다. 태국 방콕의 여러 과수원에서 다양한 과일 나무들에서 얻어진 근권계 토양에서 304개의 방선균 목에 속하는 균주를 분리하였다.57) 이 중에서 예비실험을 통해 선별된 16개의 Streptomyces 균주를 S. agalactiae 2809 A. jandaei 1929, A. veronii 1930, E. ictaluri에 대한 항균 활성을 실험하였다.
쑥(sagebrush, Artemisia tridentata)의 근권계 토양에서 202개의 방선균 목에 속하는 균주들 중에서 42개의 강력한 항진균 효과를 나타내는 균주를 선별하여 균에 대한 억제활성 능력을 평가하였다.58) 16s rDNA 염기서열 분석을 통해 27개의 균주가 Streptomyces 속으로 밝혀졌으며 Streptomyces sp. KACC91020과 가장 유사한 균주의 배양액 추출물이 Candida 균에 대한 가장 강력한 억제 활성을 나타내었다.
2023년에는 중국 상동 지방의 허쩌(Heze, Shandong, China)에 서식하는 은행나무(Ginkgo biloba L.)의 근권계 토양에서 Streptomyces sp.에 속하는 균주 Streptomyces. sp. HP-A2021를 분리하였다.59) 이 균주의 배양액 추출물은 5개의 인체 유해균에 대해 억제활성이 평가되었으며, E. faecium과 S. aureus 균주에 대해 각각 99.6%와 98.9%로 높은 활성을 나타내었다.
인도의 타밀 나두 주의 테니 지역에 있는 고츠 산맥의 서쪽(Ghats, Theni zone, Tamil Nadu, India)에서 서식하는 대나무(bamboo plants)의 근권계 토양으로부터 Streptomyces sp. 균주를 분리하였다.60) 이 균주는 S. aureus, B. subtilis, S. pyogens에 대해 억제 활성을 나타내었다.
중국의 헤난 지역에서 헤난 중의학 대학교(Henan university of Chinese Medicine, Henan Province)의 약용식물원에 서식하는 지황(Rehmannia glutinosa)의 근권계 토양에서 신규 지질펩타이드를 생산하는 균주 Streptomyces sp. RerS4가 분리되었다.61) 이 균주의 배양액의 추출물은 여러 진균에 대해 억제 활성을 나타내었으며, 별도로 명명되지 않은 신규 지질펩타이드(39)는 B. subtilis ATCC 21332와 E, coli CGMCG 1.1521에 (MIC) 20.3±2.5과 70.8±3.7 μg/mL의 억제활성을 나타내었다. 중국 윈난성 원산지역(Wenshan region, Yunnan province)에서 3년생 삼칠삼(Panax notoginseng)의 근권계 토양에서 Streptomyces sp. SYP-A7185 균주가 분리되었다.62) 5개의 다른 화학적 형태의 안트라퀴논이 10개가 확인되었고, 이 중 3개의 기지 물질(40-42) 신규물질 amicemycinone (43)과 danthronmycin (44)은 E. faecium, S. aureus, K. pneumoniae에 억제활성을 나타내었다. 아프리카 바질(Ocimum gratissimum)의 근권계 토양에서 분리된 균주 Streptomyces sp.로부터 Klebsiella pneumoniae, P. aeruginosa, E. coli에 대해 억제 활성을 나타내었다.63)
Río Lacarón in La Garrovilla, Spain, 해발 215 m에서 올리브 나무(Olea europaea)의 근권계로부터 Streptomyces sp. 균주를 분리하였다.64) 이 균주는 올리브 나무에 심각한 질병을 일으키는 Verticillium dahliae에 대해 활성을 나타내었으며, 특히 그 활성을 나타내는 물질은 기지물질인 albocycline (45)로 확인되었다.
에티오피아의 하와사의 리프트밸리 지역(Rift valley of Hawassa, Ethiopia)에서 얻어진 근권계 토양에서 Streptomyces monomycini strain RVE129가 분리되었다.65) 이 균주의 배양액의 추출물은 S. aureus ATCC25923에 대해 억제활성을 나타내었다.
3개월 된 레이디 플리머스(Lady Plymouth, Pelargonium graveolens)의 근권계 토양에서 분리된 균주 AC-40은 Streptomyces vinaceusdrappus로 확인되었다.66) 이 균주 배양액의 추출물은 S. aureus ATCC6538, B. cereus ATCC33018, P. aeruginosa ATCC27853 E. coli 그리고 C. albicans ATCC60193에 억제 활성을 나타내었다.
수마트라의 토바 사모시르(Toba Samosir, Sumatra) 식물 Dacrycarpus imbricatus의 근권계 토양에서 Streptomyces sp.에 속하는 균주들이 분리되었다.67) 이 균주들은 약간의 항산화 활성을 나타내었지만 S. aureus와 M. smegmatis에 대해 억제활성을 나타내었다.

Anti-microbial activity of secondary metabolites isolated from Streptomyces sp. originated from rhizosphere soils
인도의 북동쪽에 위치한 아쌈에서 숲생태계 보호구역인 포비토라 야생보호구역(Pobitora wildlife sanctuary, Assam, Northeastern India)의 여러 식물들의 근권계 토양에서 Streptomyces sp. PBR19 균주를 분리하였다.68) 이 균주는 Acinetobacter baumanii ATCC BAA-1705 균주에 대해 억제 활성을 나타내었다. GC-MS 분석을 통해 이 균주의 배양액의 추출물에서는 8개의 항균활성을 나타내는 기지물질이 확인되었다.
이집트의 7개의 다양한 지역에서 쌀, 밀, 그리고 꽃들을 포함한 다양한 근권계 토양 시료를 확보하였고, 58개의 Streptomyces sp. 균주들을 분리하였다.69) 이 균주들은 L. monocytogenes, E. coli O157 그리고 A. Baumannii 균주에 대해 억제 활성이 평가되었다.
강황의 근권계에서 얻어진 토양에서 균주 Streptomyces levis가 분리되었다.70) 이 균주의 분획물은 S. aureus, E. coli, 그리고 C. albicans에 대해 억제활성을 나타내었다. 이 논문에서는 고해상도 질량분석기(HRMS)와 FTIR (Fourier Transform Infra-Red, 적외선흡수분광기)를 이용하여 분획물에서 가장 풍부한 물질을 추정하였으며, 이 물질은 isofucosterol 계열의 기지 물질 3-O-[6-O-(9-)-b-D-glucopyranoside (46)로 확인되었다.
태국의 나콘파톰(Nakhon Pathom, Thailand)에서 동남아시아에 주로 재배되는 생강과 식물 핑거루트(fingerroot, Boesenbergia rotunda (L.) Mnsf.의 근권계에서 36개의 방선균 목에 속하는 균주를 분리하였고, B. subtilis (ATCC6633), B. cereus (ATCC 7064), S. aureus (ATCC 25923)에 대해 억제능을 평가하였다.71) 그 중 가장 우수한 활성을 보인 균주에 대해 16s rDNA 분석을 통해 Streptomyces chartreusis에 가장 유사함을 확인하였다. 이 균주에서의 가장 뛰어난 활성을 나타내는 물질은 2(5)-5,7,2-trihydroxy-8 methoxyflavanone (47)와 2 (S)-5,2,5-trihydroxy-7,8 dimethoxyflavanone (48)으로 동정되었다. 동일 연구팀이 같은 지역에서 강황 Curcuma longa의 근권계에서 45개의 방선균 목에 속하는 균주를 분리하였고, 활성이 뛰어난 균주 Streptomyces sp. SU84를 선별하였다.72) 이 균주는 기지물질 lupeol (49)과 신규 물질 1,3 dihydroxy-2',2'-dimethylpyrano-(5,6)-xanthone (50)을 생산하였는데, 이물질들은 S. aureus, E. coli, B. subtilis에 대해 억제 활성을 나타내었다. 브라질의 마라냐오의 상루이스 (São Luís, MA, Brazil)의 대학교 약용정원에서 얻어진 다양한 근권계 토양에서 Streptomyces 속에 속하는 균주를 분리하였다.73) 이 균주는 Streptomyces kronopolitis strain NEAU-MLK8T와 가장 유사하였다.
결론 및 고찰
항균 활성을 갖는 물질을 찾기 위한 연구는 계속해서 진행되어 왔으나, 최근 30년간 개발된 약들은 새로운 작용기전의 발견에 기인한 경우는 그 수가 매우 적다. 현재 과학 기술의 발달로 인해 유전공학적 연구를 통해 미생물을 대상으로 다양한 연구가 진행되고 있지만, 이러한 연구 접근 방법으로도 새로운 작용기전을 갖는 항생제의 발견은 잘 이루어지지 않고 있다. 하지만, 새로운 방선균 균주를 발견 및 배양하여 작용기전을 새로이 발굴해내는 것은 과거 항생제의 황금기라 불리던 시절과 같은 연구 접근 방법이라고 생각된다. 본 논문에서 살펴본 바와 같이, 식물의 근권계균에서 얻어진 Streptomyces sp.의 배양액의 추출물과 그 이차대사물질들의 항균활성은 몇몇의 사례를 제외하고는 모두 인체에 유해한 균에 대해 나타났다. 따라서 그 동안 항균 활성을 목적으로 연구되지 않았던 분야 혹은 최근까지 연구가 진행되지 않았던 지역 혹은 환경에서의 항균 활성을 찾기 위한 연구는 현재 새로운 작용기전을 찾아 새로운 항생제의 개발의 선도할 수 있을 것으로 사료되며 근권계 방선균 역시 좋은 소재로 생각된다.
Acknowledgments
이 논문은 2022학년도 경북대학교 신임교원 정착연구비에 의하여 연구되었음.
References
-
Flasche, S. and Atkins, K. E. (2018) Balancing benefits and risks of antibiotic use. J. Infect. Dis.218: 1351-1353.
[https://doi.org/10.1093/infdis/jiy344]

-
Salam, M. A., Al-Amin, M. Y., Salam, M. T., Pawar, J. S., Akhter, N., Rabaan, A. A. and Alqumber, M. A. A. (2023) Antimicrobial resistance: A growing serious threat for global public health. Healthcare11: 1946.
[https://doi.org/10.3390/healthcare11131946]

-
Prescott, J. F. (2014) The resistance tsunami, antimicrobial stewardship, and the golden age of microbiology. Vet. Microbiol.171: 273-278.
[https://doi.org/10.1016/j.vetmic.2014.02.035]

-
Dhole, S., Mahakalkar, C. and Kshirsagar, S. (2023) Antibiotic prophylaxis in surgery: Current insights and future directions for surgical site infection prevention. Cureus15: 47858.
[https://doi.org/10.7759/cureus.47858]

-
García-Castro, M., Sarabia, F., Díaz-Morilla, A. and López Romero, J. M. (2023) Approved antibacterial drugs in the last 10 years: from the bench to the clinic. Explor. Drug Sci.1: 180–209.
[https://doi.org/10.37349/eds.2023.00013]

-
Lee, Y., Choi, Y., He, H. and Dodd, M. C. (2019) Degradation and deactivation of bacterial antibiotic resistance genes during exposure to free chlorine, monochloramine, chlorine dioxide, ozone, ultraviolet light, and hydroxyl radical. Environ. Sci. Technol.53: 2013-2016.
[https://doi.org/10.1021/acs.est.8b04393]

-
Toner, E., Adalja, A., Gronvall, G. K., Cicero, A. and Inglesby, T. V. (2015) Antimicrobial resistance is a global health emergency. Health Secur.13: 153-155.
[https://doi.org/10.1089/hs.2014.0088]

-
Xiong, Z. Q., Wang, J. F., Hao, Y. Y. and Wang, Y. (2013) Recent advances in the discovery and development of marine microbial natural products. Mar. Drugs11: 700-717.
[https://doi.org/10.3390/md11030700]

-
Berdy, J. (2005) Bioactive microbial metabolites. J. Antibiot.58: 1–26.
[https://doi.org/10.1038/ja.2005.1]

-
Rampelotto, P. H. (2014). Polar microbiology: Recent advances and future perspectives. Biology3: 81-84.
[https://doi.org/10.3390/biology3010081]

-
Shen, X., Hu, H., Peng, H., Wang, W. and Zhang, X. (2013). Comparative genomic analysis of four representative plant growth-promoting rhizobacteria in Pseudomonas. BMC Genomics14: 1-20.
[https://doi.org/10.1186/1471-2164-14-271]

-
Jose, P. A. and Jebakumar, S. R. D. (2013) Phylogenetic appraisal of antagonistic, slow growing actinomycetes isolated from hypersaline inland solar salterns at Sambhar salt lake, India. Front. Microbiol.4: 190.
[https://doi.org/10.3389/fmicb.2013.00190]

-
Keikha, N., Mousavi, S. A. A., Nakhaei, A. R., Yadegari, M. H., Bonjar, G. H. S. and Amiri, S. (2015) In vitro evaluation of enzymatic and antifungal activities of soil-Actinomycetes isolates and their molecular identification by PCR. Jundishapur J. Microbiol. 8: e14874.
[https://doi.org/10.5812/jjm.8(5)2015.14874]

- Suksaard, P., Pathom-aree, W. and Duangmal, K. (2017) Diversity and plant growth promoting activities of actinomycetes from mangroves. Chiang Mai J. Sci.44: 1210-1223.
-
Kämpfer, P. Dworkin, M., Falkow, S., Rosenberg, E., Schleifer, K. H. and Stackebrandt, E. (2006). The Family Streptomycetaceae, Part I: Taxonomy. In (eds.). The Prokaryotes 538–604.
[https://doi.org/10.1007/0-387-30743-5_22]

-
Otten, H. (1986) Domagk and the development of the sulphonamides. J. Antimicrob. Chemother.17: 689-690.
[https://doi.org/10.1093/jac/17.6.689]

- Fleming, A. (1929) On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae. Br. J. Exp. Pathol.10: 226-236.
-
Abraham, E. P., Chain, E., Fletcher, C. M., Gardner, A. D., Heatley, N. G., Jennings, M. A. and Florey, H. W. (1941) Further observations on penicillin. Lancet.238: 177-189.
[https://doi.org/10.1016/S0140-6736(00)72122-2]

-
Waksman, S. A., Schatz, A. and Reynolds, D. M. (2010) Production of antibiotic substances by actinomycetes. Ann. N. Y. Acad. Sci.1213: 112-124.
[https://doi.org/10.1111/j.1749-6632.2010.05861.x]

-
Schatz, A., Bugle, E. and Waksman, S. A. (1944) Streptomycin, a substance exhibiting antibiotic activity against Gram-positive and Gram-negative bacteria. Exp. Biol. Med.55: 66–69.
[https://doi.org/10.3181/00379727-55-14461]

-
Jones, D., Metzger, H. J., Schatz, A. and Waksman, S. A. (1944) Control of gram-negative bacteria in experimental animals by streptomycin. Science100: 103–105.
[https://doi.org/10.1126/science.100.2588.103.b]

-
Duggar, B. M. (1948) Aureomycin: a product of the continuing search for new antibiotics. Ann. N. Y. Acad. Sci.51: 177–181.
[https://doi.org/10.1111/j.1749-6632.1948.tb27262.x]

-
Chopra, I. and Roberts, M. (2001) Tetracycline antibiotics: mode of action, applications, molecular biology, and epidemiology of bacterial resistance. Microbiol. Mol. Biol. Rev.65: 232–260.
[https://doi.org/10.1128/MMBR.65.2.232-260.2001]

- Landau, R., Achilladelis, B. and Scriabine, A. (1999) Pharmaceutical Innovation: Revolutionizing Human Health. Chemical Heritage Press, Philadelphia, PA, USA.
- Kloepper, J. W. and Schroth, M. N. (1978) Plant growth promoting rhizobacteria on radishes. In Proceedings of the 4th International Conference on Plant Pathogenic Bacteria, Angers, France, 879–882.
-
Ehinmitan, E., Losenge, T., Mamati, E., Ngumi, V., Juma, P. and Siamalube, B. (2024) BioSolutions for green agriculture: Unveiling the diverse roles of plant growth-promoting rhizobacteria. Int. J. Microbiol. 6181491.
[https://doi.org/10.1155/2024/6181491]

-
Naamala J., Jaiswal, S. K. and Dakora, F. D. (2016) Antibiotics Resistance in rhizobium type, process, mechanism and benefit for agriculture. Curr. Microbiol. 72: 804-816.
[https://doi.org/10.1007/s00284-016-1005-0]

-
Gesheva, V. and Gesheva, R. (2000) Physiological and antagonistic potential of actinomycetes from loquat rhizosphere. Microbiol. Res.155: 133-135.
[https://doi.org/10.1016/S0944-5013(00)80049-X]

-
Basil, A. J., Strap, J. L., Knotek-Smith, H. M. and Crawford, D. L. (2004) Studies on the microbial populations of the rhizosphere of big sagebrush (Artemisia tridentata). J. Ind. Microbiol. Biotechnol.31: 278-288.
[https://doi.org/10.1007/s10295-004-0140-y]

-
Zamanian, S., Bonjar, G. H. S. and Saadoun, I. (2005) First report of antibacterial properties of a new strain of Streptomyces plicatus (strain 101) against Erwinia carotovora subsp. carotovora from Iran. Biotechnology4: 114–120.
[https://doi.org/10.3923/biotech.2005.114.120]

-
Zhu, H. H., Guo, J., Yao, Q., Yang, S. Z., Deng, M. R. and Li, T. H. (2011) Streptomyces caeruleatus sp. nov., with dark blue diffusible pigment. Int. J. Syst. Evol. Microbiol.61: 507-511.
[https://doi.org/10.1099/ijs.0.017392-0]

-
Lee, H. J., Han, S. I. and Whang, K. S. (2012) Streptomyces gramineus sp. nov., an antibiotic-producing actinobacterium isolated from bamboo (Sasa borealis) rhizosphere soil. Int. J. Syst. Evol. Microbiol.62: 856-859.
[https://doi.org/10.1099/ijs.0.030163-0]

-
Ostash, B., Gren, T., Hrubskyy, Y., Tistechok, S., Beshley, S., Baranov, V. and Fedorenko, V. (2014) Cultivable actinomycetes from rhizosphere of birch (Betula pendula) growing on a coal mine dump in Silets, Ukraine. J. Basic Microbiol.54: 851-857.
[https://doi.org/10.1002/jobm.201200551]

-
Mingma, R., Pathom-aree, W., Trakulnaleamsai, S., Thamchaipenet, A. and Duangmal, K. (2014) Isolation of rhizospheric and root endophytic actinomycetes from Leguminosae plant and their activities to inhibit soybean pathogen, Xanthomonas campestris pv. glycine. World J. Microbiol. Biotechnol.30: 271-280.
[https://doi.org/10.1007/s11274-013-1451-9]

-
Nguyen, T. M. and Kim J. (2015) Streptomyces bambusae sp. nov. Showing antifungal and antibacterial activities, isolated from amboo (Bambuseae) rhizosphere soil using a modified culture method. Curr. Microbiol. 71: 658-68.
[https://doi.org/10.1007/s00284-015-0899-2]

-
Özakin, S., Davis, R. W., Umile, T. P., Pirinccioglu, N., Kizil, M., Celik, G. and İnce, E. (2016) The isolation of tetrangomycin from terrestrial Streptomyces sp. CAH29: Evaluation of antioxidant, anticancer, and anti-MRSA activity. Med. Chem. Res.25: 2872-2881.
[https://doi.org/10.1007/s00044-016-1708-6]

-
Wattanasuepsin, W., Intra, B., Euanorasetr, J., Watanabe, Y., Mingma, R., Fukasawa, W., Phinyocheep, P., Okabe, T., Nakashima, T. and Panbangred, W. (2017) 1-Methoxypyrrole-2-carboxamide—A new pyrrole compound isolated from Streptomyces griseocarneus SWW368. J. Gen. Appl. Microbiol.63: 207-211.
[https://doi.org/10.2323/jgam.2016.10.006]

-
Kumar, P. S., Paulraj, M. G. and Savarimuthu, I. (2017) In vitro antagonistic activity of soil Streptomyces collinus DPR20 against bacterial pathogens. J. Microbiol. Biotechnol. Food Sci.7: 317-324.
[https://doi.org/10.15414/jmbfs.2017/18.7.3.317-324]

-
Parmar, R. S., Singh, C. and Kumar, A. (2017) Optimization of cultural parameters for pigment production from Streptomyces flavofuscus ARITM02, isolated from rhizosphere soil. Int. J. Curr. Microbiol. Appl. Sci.6: 961-966.
[https://doi.org/10.20546/ijcmas.2017.602.108]

-
Rodrigues, J. P., Peti, A. P. F., Figueiró, F. S. and de Souza Rocha, I. (2018) Bioguided isolation, characterization, and media optimization for production of lysolipins by actinomycete as antimicrobial compound against Xanthomonas citri subsp. citri. Mol. Biol. Rep.45: 2455-2467.
[https://doi.org/10.1007/s11033-018-4411-5]

-
Zhao, K., Li, J., Zhang, X. and Chen, Q. (2018) Actinobacteria associated with Glycyrrhiza inflata Bat. are diverse and have plant growth promoting and antimicrobial activity. Sci. Rep.8: 13661.
[https://doi.org/10.1038/s41598-018-32097-8]

-
Ayed, A., Slama, N., Mankai, H., Bachkouel, S., ElKahoui, S., Tabbene, O. and Limam, F. (2018) Streptomyces tunisialbus sp. nov., a novel Streptomyces species with antimicrobial activity. Antonie Van Leeuwenhoek111: 1571-1581.
[https://doi.org/10.1007/s10482-018-1046-4]

-
Yun, T. Y., Feng, R. J., Zhou, D. B., Pan, Y. Y., Chen, Y. F. and Wang, F. (2018) Optimization of fermentation conditions through response surface methodology for enhanced antibacterial metabolite production by Streptomyces sp. 1-14 from cassava rhizosphere. PLoS ONE13: e0206497.
[https://doi.org/10.1371/journal.pone.0206497]

-
Nafis, A., Oubaha, B., Elhidar, N., Ortlieb, N., Kulik, A., Niedermeyer, T., Hammerschmidt, F. and Barakate, M. (2018). Novel production of two new nonpolyenic antifungal macrolide derivatives by Streptomyces Z26 isolated from Moroccan rhizospheric soil. Online J. Biol. Sci.18: 176-185.
[https://doi.org/10.3844/ojbsci.2018.176.185]

-
Kihara, T., Koshino, H., Shin, Y. C., Yamaguchi, I. and Isono, K. (1995) Liposidolide A, a new antifungal macrolide antibiotic. J. Antibiot.48: 1385-1387.
[https://doi.org/10.7164/antibiotics.48.1385]

-
Tanaka, Y., Komaki, H., Yazawa, K., Mikami, Y. and Nemoto, A. (1997) Brasilinolide A, a new macrolide antibiotic produced by Nocardia brasiliensis: Producing strain, isolation and biological activity. J. Antibiot. 50: 1036-1041.
[https://doi.org/10.7164/antibiotics.50.1036]

- Nafis, A., Elhidar, N., Oubaha, B., Samri, E., Niedermeyer, T., Ouhdouch, Y., Hassani, L. and Barakate, M. (2018) Screening for non-polyenic antifungal produced by Actinobacteria from Moroccan habitats: Assessment of antimycin A19 production by Streptomyces albidoflavus AS25. Int. J. Mol. Cell. Med.7: 133-145.
-
Sheik, G. B., Raheim, A. I. A. A., Alzeyadi, Z. A. and AlGhonaim, M. I. (2019) Extracellular synthesis, characterization and antibacterial activity of silver nanoparticles by a potent isolate Streptomyces sp. DW102. Asian J. Biol. Life Sci.8: 89.
[https://doi.org/10.5530/ajbls.2019.8.15]

-
Nishioka, T., Marian, M. and Kobayashi, I. (2019) Microbial basis of Fusarium wilt suppression by Allium cultivation. Sci. Rep.9: 1715.
[https://doi.org/10.1038/s41598-018-37559-7]

-
Hao, L., Wang, Y., Chen, X., Zheng, X., Chen, S., Li, S., Li, Y., Feng, W. and Xu, Y. (2019) Exploring the potential of natural products from mangrove rhizosphere bacteria as biopesticides against plant diseases. Plant Dis.103: 2925-2932.
[https://doi.org/10.1094/PDIS-11-18-1958-RE]

-
Peng, F., Zhang, M. Y. and Hou, S. Y. (2020) Insights into Streptomyces spp. isolated from the rhizospheric soil of Panax notoginseng: isolation, antimicrobial activity and biosynthetic potential for polyketides and non-ribosomal peptides. BMC Microbiol.20: 143.
[https://doi.org/10.1186/s12866-020-01832-5]

-
Bekiesch, P., Zehl, M., Domingo-Contreras, E. and Martín, J. (2020) Viennamycins: Lipopeptides Produced by a Streptomyces sp. J. Nat. Prod.83: 2381-2389.
[https://doi.org/10.1021/acs.jnatprod.0c00152]

-
Dede, A., Güven, K. and Şahi, N. N. (2020) Isolation, plant growth-promoting traits, antagonistic effects on clinical and plant pathogenic organisms and identification of actinomycetes from olive rhizosphere. Microb. Pathog. 143: 104134.
[https://doi.org/10.1016/j.micpath.2020.104134]

-
Yuan, J., Wang, L. and Ren, J. (2020) Antibacterial pentacyclic polyketides from a soil-derived from a - Streptomyces. J. Nat. Prod.83: 1919-1924.
[https://doi.org/10.1021/acs.jnatprod.0c00161]

-
Sujarit, K., Mori, M., Dobashi, K., Shiomi, K., Pathom-Aree, W. and Lumyong, S. (2020) New antimicrobial phenyl alkenoic acids isolated from an oil palm rhizosphere-associated Actinomycete, Streptomyces palmae CMU-AB204T. Microorganisms8: 350.
[https://doi.org/10.3390/microorganisms8030350]

-
Saadouli, I., Zendah El Euch, I., Trabelsi, E., Mosbah, A., Redissi, A., Ferjani, R., Ben Jeddou, H. and Ouzari, H. I. (2020) Isolation, characterization and chemical synthesis of large spectrum antimicrobial cyclic dipeptide (L-leu-L-pro) from Streptomyces misionensis V16R3Y1 bacteria extracts. A novel 1H NMR metabolomic approach. Antibiotics9: 270.
[https://doi.org/10.3390/antibiotics9050270]

- Euanorasetr, J., Chotboonprasit, V., Ngoennamchok, W., Thongprathueang, S., Promprateep, A., Taweesaga, S., Chatsangjareon, P. and Intra, B. (2020) Isolation and characterization of aerobic actinomycetes with probiotic properties in Nile tilapia. J. Appl. Pharm. Sci.10: 40-49.
- González-Franco, A. C. and Robles-Hernández, L. (2009) Actinomycetes as biological control agents of phytopathogenic fungi. Tecnociencia Chihuahua3: 64-73.
-
Gonzalez-Franco, A. C. and Robles-Hernández, L. (2022) Antagonist activities and phylogenetic relationships of actinomycetes isolated from an Artemisia habitat. Rev. Argent. Microbiol.54: 326-334.
[https://doi.org/10.1016/j.ram.2022.05.003]

-
Sriragavi, G., Sangeetha, M. and Santhakumar, M. (2023) Exploring antibacterial properties of bioactive compounds isolated from Streptomyces sp. in bamboo rhizosphere soil. ACS Omega8: 36333-36343.
[https://doi.org/10.1021/acsomega.3c04954]

-
Kadaikunnan, S., Alharbi, N. S., Khaled, J. M. and Alobaidi, A. S. (2023) Biocontrol property of Streptomyces parvulus VRR3 in green gram plant (Vigna radiata L.) against Fusarium solani in greenhouse. Physiol. Mol. Plant Pathol.128: 102128.
[https://doi.org/10.1016/j.pmpp.2023.102128]

-
Xue, J. Y., Wu, Y. Y. and Han, Y. L. (2023) Anthraquinone metabolites isolated from the rhizosphere soil Streptomyces of Panax notoginseng (Burk.) F. H. Chen target MMP2 to inhibit cancer cell migration. J. Ethnopharmacol.312: 116457.
[https://doi.org/10.1016/j.jep.2023.116457]

-
Ifediora, R. G., Anyamene, C. O., Ikele, M. O. and Ezebialu, C. U. (2023) GC-MS based metabolomic profiling of Streptomyces clavuligerus isolated from Ocimum gratissimum rhizosphere. J. Adv. Microbiol.23: 28-35.
[https://doi.org/10.9734/jamb/2023/v23i8741]

-
Calvo-Peña, C., Cobos, R., Sánchez-López, J. M., Ibañez, A. and Coque, J. J. R. (2023) Albocycline is the main bioactive antifungal compound produced by Streptomyces sp. OR6 against Verticillium dahliae. Plants (Basel)12: 3612.
[https://doi.org/10.3390/plants12203612]

-
Elias, F., Muddada, S., Muleta, D. and Tefera, B. (2023) Improved antibiotic activity from Streptomyces monomycini strain RVE129 using classical and statistical design of experiments. Biomed. Pharmacol. J.16: 973-988.
[https://doi.org/10.13005/bpj/2679]

-
Sedeek, A. M., Salah, I., Kamel, H. L., Soltan, M. A., Nour, E., Alshammari, A., Elsayed, A. M. and Elsayed, T. R. (2023) Genome-based analysis of the potential bioactivity of the terrestrial Streptomyces vinaceusdrappus strain AC-40. Biology12: 345.
[https://doi.org/10.3390/biology12030345]

- Fathoni, A., Putri, A. L., Wulansari, D. and Agusta, A. (2023) Biological potency of actinomycetes extracts from rhizosphere soil of Dacrycarpus imbricatus from Toba Samosir, North Sumatra. J. Appl. Pharm. Sci.13: 146-153.
-
Mazumdar, R. and Thakur, D. (2024) Antibacterial activity and biosynthetic potential of Streptomyces sp. PBR19, isolated from forest rhizosphere soil of Assam. Braz. J. Microbiol.55: 3335-3352.
[https://doi.org/10.1007/s42770-024-01454-3]

-
Abdelaziz, R., Abd El-Hamid, M. I. and El-Wafaei, N. (2024) Phage-resistant Streptomyces abietis and its telomycin bioactive metabolite as a possible alternative to antibiotics. Microb. Pathog.194: 106822.
[https://doi.org/10.1016/j.micpath.2024.106822]

-
Abdelaziz, R., Abd El-Hamid, M. I., El-Wafaei, N., Ghaly, M. F., Askora, A., Gamal, E. D., Mansour, M. H. and Eissa, S. A. (2024) Phage-resistant Streptomyces abietis and its telomycin bioactive metabolite as a possible alternative to antibiotics. Microb. Pathog.194: 106822.
[https://doi.org/10.1016/j.micpath.2024.106822]

-
Taechowisan, T., Chuen-Im, T. and Phutdhawong, W. S. (2024) Antibacterial and anti-inflammatory properties of flavonoids from Streptomyces chartreusis RH3.5. Pak. J. Biol. Sci.27: 244-255.
[https://doi.org/10.3923/pjbs.2024.244.255]

-
Taechowisan, T., Chuen-Im, T. and Phutdhawong, W. S. (2024) Antioxidant and antibacterial properties of 1,3-dihydroxy-, 2',2'-dimethylpyrano-(5,6)-xanthone from Streptomyces sp. SU84. Pak. J. Biol. Sci.27: 132-141.
[https://doi.org/10.3923/pjbs.2024.132.141]

-
De Azevedo, V. L. S., Rosa, F. C., Dias, L. R. L., Batista, L. A., Melo, M. C., Sales, L. A. T., Branco, A. J. M., Araújo, T. R. R., de Miranda, R. C. M. and Aliança, A. S. D. S. (2024) An evaluation of the antibacterial, antileishmanial, and cytotoxic potential of the secondary metabolites of Streptomyces sp. ARH (A3). Microorganisms12: 476.
[https://doi.org/10.3390/microorganisms12030476]