
RAW 264.7 세포에서 민자루미끌부채 추출물의 항염효과
Correspondence to: *(E-mail): shimjh@swu.ac.kr (Tel) : +82-2-970-1142
Abstract
This study aimed to evaluate the anti-inflammatory effects of Lesleigha yamadae extract on skin, using the RAW 264.7 macrophage cell line. The anti-inflammatory effects of L. yamadae extract were evaluated by examining cell viability, gene expressions, and the levels of nitric oxide (NO)/prostaglandin E2 (PGE2) in RAW 264.7 cells. Pro-inflammatory gene expression (IL-1α, IL-1β, IL-6, TNF-α) and the levels of NO/PGE2 were analyzed to elucidate the anti-inflammatory effects of L. yamadae extract. Quantitative real-time polymerase chain reaction (Real-time RT-qPCR) analysis revealed a significant decrease in the mRNA levels of IL-1α/β, IL-6 and TNF-α following treatment with L. yamadae extract. Furthermore, reduced levels of PGE2 and NO confirmed that L. yamadae extract possesses anti-inflammatory properties. These results suggest that L. yamadae extract contains bioactive compounds capable of modulating inflammatory responses. Further studies on the mechanisms underlying its anti-inflammatory effects could contribute to the development of cosmeceutical products as well as pharmacological therapies.
Keywords:
Lesleigha yamadae, Nitric oxide, PGE2, Interleukin, Anti-inflammation염증은 박테리아와 같은 외부 자극원 또는 사멸한 세포 등을 포함하는 자극으로부터 자신을 보호하는 면역 반응으로 알려져 있다.1) 염증은 조직과 세포를 보호하기 위한 면역반응이지만, 과도한 상태가 지속되면 퇴행성 뇌질환, 고혈압, 관절염, 아토피 및 암 등 다양한 질병을 유발하고 인체 조직을 손상시킬 수 있다.1)
세균의 세포벽 성분인 lipopolysaccharide (LPS)는 대식세포의 세포막에 존재하는 톨-유사 수용체(Toll-like receptor; TLR)를 통해 인식되어 대식세포 내에서 mitogen-activated protein kinase (MAPK) 및 nuclear factor kappa beta (NF-ĸB)와 같은 여러 신호전달경로를 활성화시킨다. 이로 인해 프로스타글란딘 E2 (PGE2)와 산화질소(nitric oxide; NO)가 분비되고 염증을 조절하게 된다. 또한 interleukin-1α/β, (IL-1α/β), IL-6, tumor necrosis factor-α (TNF-α)와 같은 사이토카인 및 케모카인의 생성이 증가한다.2,3) 특히 대식세포는 식세포 작용과 항원 제시, 면역조절의 기능을 통해 면역반응을 조절하며, 이를 위해 염증매개인자와 사이토카인을 분비한다.2-5) 이러한 사이토카인과 염증매개인자는 면역기능을 강화시키고 주변세포를 보호하는 역할을 하지만, 과도한 PGE2와 NO는 염증을 유발할 수 있다.6) 일반적으로 NO는 외부에서 침입한 세균을 죽이거나 종양 억제에 기여하지만, 과도하게 생성된 NO는 주변 세포들의 유전변이, 신경손상 등을 초래할 수 있다.7-9) 따라서 NO, PGE2, 염증성 사이토카인과 케모카인의 생성을 억제하는 것은 염증과 관련된 질환의 예방과 치료에 중요한 전략이 될 수 있다.
민자루미끌부채(Lesleigha yamadae (Okamura & Segawa) G. W. Saunders & Kraft, 2011)는 조하대 암반층에 부착하여 자라며, 필리핀과 일본에서 주로 분포하고 국내에서는 제주도와 인근 도서에서 발견된다. 진한 암적색의 파상을 띠며, 5~7월에 조하대 수심 20~30 m에서 자란다고 알려져 있다. L. yamadae는 Segawa에 의해 일본의 Susaki 지역에서 분포하고 있다고 보고가 된 바 있지만, L. yamadae의 성분 및 생물학적 활성에 관한 연구는 전무한 실정이다.10)
특별히 L. yamadae이 면역세포인 RAW 264.7 대식세포주에서 염증에 효과가 있는지 보고된 바가 없다. 따라서 본 연구에서는 LPS에 의해 염증반응이 유발된 RAW 264.7 세포에 L. yamadae를 처리하였을 때의 항염증 효과를 확인하였다. L. yamadae에 의한 RAW 264.7 세포주의 생존률과 대식세포가 발현하는 NO, PGE2 호르몬, 그리고 사이토카인 관련 유전자의 발현 등을 Real-time RT-qPCR과 ELISA 등의 실험법을 통해 분석하였다.
재료 및 방법
실험시료 및세포배양 -실험에서 사용된 민자루미끌부채(Lesleigha yamadae)는 2017년 7월 21일 제주특별자치도 서귀포시 근해에서 채집하였으며, 민자루미끌부채의 추출물을 국립해양생물자원관의 해양바이오뱅크에서 분양받아 사용하였다(NP30200003). 민자루미끌부채는 전 부위를 동결건조한 후 40 g의 시료를 70% EtOH (400 mL)을 용매로 사용하여 1 h씩 3차례 WUC N30H 소니케이터(Daihan Science, Korea)를 사용해 추출하였고, 여과 후 감압농축 및 동결건조하여 파우더 상태의 시료를 10 mg/mL의 농도로 70% EtOH에 녹여 실험에 사용하였다.
RAW 264.7 세포는 한국세포주은행(Korean Cell Line Bank, Korea)에서 구입하였다. 세포는 1% penicillin/streptomycin (Thermo Fisher Scientific, USA)와 10% 우태아혈청(Welgene, Korea)이 첨가된 DMEM (Welgene)을 이용하여 인큐베이터에서 배양하였다.
세포생존률검증 -L. yamadae 추출물에 대한 세포 생존률은 CCK-8 solution (DoGen, Korea)을 사용하여 분석하였다. 24 well 조직 배양 접시에 2 X 104개의 RAW 264.7 세포를 접종하고 우태아혈청이 첨가된 배지를 사용하여 24 h 동안 선배양한 후, L. yamadae 추출물을 농도 별로 희석하여 24 h 처리하였다. 이후 phenol-red 및 우태아혈청 무첨가 배지에 CCK-8 solution을 희석(1/10)하여 0.5 h 동안 반응시킨 후, Microplate reader (450 nm; BioTek, USA)로 흡광도를 측정하였고, 세포가 없는 희석액의 흡광도를 blank로 하여 백분율을 표시하였다.
실시간 유전자 중합효소 연쇄반응(Real-time RT-qPCR)- INFUSION TECH 사의 PureTM Total RNA extraction kit (Korea)를 사용하여 세포의 total RNA를 추출하였다. SuperiorScriptTM III reverse-transcriptase (Enzynomics, Korea)로 cDNA를 합성하였고, 유전자의 상대적 발현양을 분석하기 위해 LightCycler® 96 real-time PCR machine (Roche, Germany)으로 Real-time RT-qPCR 실험을 수행하였다. Table I에 분석을 위해 사용된 Taqman® Gene expression assay (Thermo Fisher Scientific)을 명기하였다.
Nitric oxide (NO)측정 -세포를6 well 조직 배양 접시에 1.5 X 105개의 세포를 접종하고 24 h 동안 우태아혈청이 첨가된 배지로 선배양 하였다. 이후 lipopolysaccharide (LPS; 100 ng/mL, Sigma, USA)와 L. yamadae 추출물을 배양배지에 농도 별로 72 h 동안 처리한 후, 상층액을 모아 원심분리하고, 상등액 100 μL를 NO detection kit (iNtRON, Korea)로 측정하였다. NO의 정량적 분석을 위하여 nitrite를 사용하여 검량선을 작성하였다. 1000 μM의 nitrite를 1/2의 농도로 연속희석하여 7.8 μM까지 희석시킨 후 100 μL씩 96 well 조직 배양 접시의 well에 각각 접종하고 50 μL의 N1 buffer를 10 min간 상온에서 반응시키고, 50 μL의 N2 buffer를 가하고 10 min 간 반응시켰다. 검량선의 관계식은 엑셀 프로그램을 이용하여 작성하였으며, y=0.0033x+0.8521(x: nitrite concentration, y: absorbance, r2=0.918)으로 정량분석 하였다. 세포가 분비하는 NO를 측정하기 위하여 100 μL의 상등액과 50 μL의 N1 buffer를 10 min간 상온에서 반응시키고, 50 μL의 N2 buffer를 가하고 10 min 간 반응시킨 후 560 nm 파장의 microplate reader (BioTek)로 흡광도를 측정하였다.
PGE2-ELISA-L. yamadae 추출물에 의한 PGE2의 생성을 확인하기 위해 세포를 6 well 조직 배양 접시에 1.5 X 105개의 RAW 264.7 세포를 접종하고 24 h 동안 우태아혈청이 첨가된 배지로 선배양한 후, LPS (100 ng/mL)와 L. yamadae 추출물을 농도 별로 6 h 동안 처리하였다. PGE2-ELISA kit (Thermo Fisher Scientific, USA)로 제조사의 프로토콜에 따라 세포가 분비하는 배양액 내의 PGE2 호르몬의 양을 측정하였다.
통계분석 -유의성검증을 위해 Student`s T-test법을 사용하여 유의수준을 p<0.05로 하여 검정하였다.
결과 및 고찰
Lesleigha yamadae 추출물의 세포 생존률 분석 -본 연구에서 활용한 RAW 264.7 세포는 식세포작용 뿐 아니라 lipopolysaccharide (LPS)와 같은 염증인자에 반응하여 염증부위에 면역세포를 불러들이는 세포이다. 또한 다양한 염증성 사이토카인을 분비해 후천성 면역을 유도하는 항원제시세포의 역할을 담당하기도 한다.11)L. yamadae 추출물의 항염 효능을 분석하기에 앞서, L. yamadae 추출물의 독성정도를 확인하기 위해 CCK-8 assay를 활용하여 생존률을 확인하였다. L. yamadae 추출물 처리군은 추출물을 1000 μg/mL의 농도에서 부터 1 ng/mL의 농도까지 1/10씩 연속희석하여 생존률을 분석하였다(Fig. 1). 1000 μg/mL 농도의 L. yamadae 추출물을 처리한 RAW 264.7 세포에서는 생존률이 유의성있게 감소한 반면(p<0.05), 100 μg/mL 농도 이하에서는 RAW264.7 대식세포의 생존률이 대조군과 유사하였기 때문에 후속적으로 진행되는 분석에서 L. yamadae 추출물을 100, 10, 1 μg/mL의 농도를 선정하여 진행하였다.
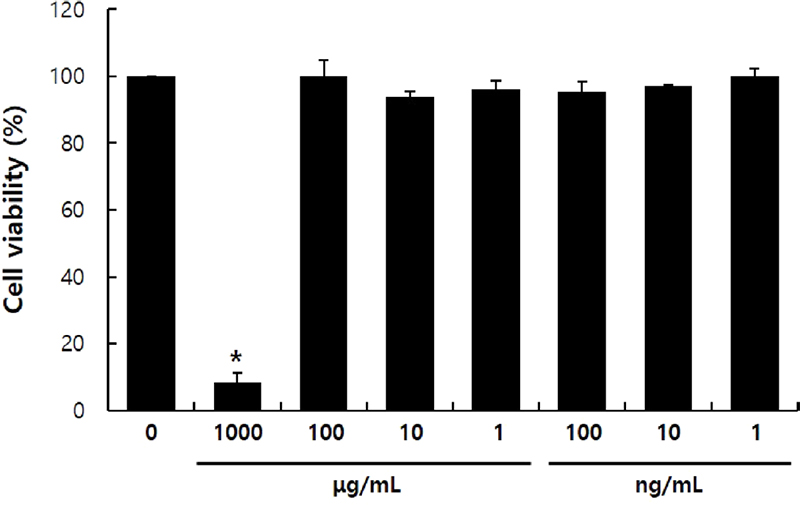
Cytotoxicity of Lesleigha yamadae extract on RAW 264.7 cells. Cells (2×104 cells/well) were cultured in 24-well plate and treated with L. yamadae extract for 24 h. Cell viability was examined using the CCK-8 assay. These data are presented as mean ± standard deviation (S.D.) of the percentage of control optical density, with triplicate measurements. Statistical significance is indicated as * relative to the control (* p<0.01).
L. yamadae 추출물이 NO 생성에 끼치는 영향 – 세포 내부의 NO synthase (NOS) 효소는 Nitric Oxide (NO)를 생성하며, 그 중 NOS2는 대식세포가 NO를 생성하는 주효소로 알려져 있다. NO는 혈압을 조절하기도 하고, 감염부위의 박테리아나 종양을 제거하고 적응면역을 발동하기 위한 신호전달을 매개하는 등의 유익한 역할을 한다고 알려져 있다.12) 하지만 과도하게 생성되는 NO는 세포 외부로 배출되어 부종을 유발하거나 신경조직의 손상을 야기한다. 또한 세포 내 유전자의 변이를 유도한다고 알려져 있다.7-9) 본 실험에서 L. yamadae 추출물에 의한 NO의 감소를 확인하였을 때, LPS에 의해 341.9 ± 15.83 μM 농도로 생성된 NO가 100, 10 μg/mL의 L. yamadae 추출물을 처리하였을 때 각각 99.3 ± 5.3, 279.2 ± 20.6 μM로 감소하였다. 이는 L. yamadae 추출물이 NO를 유의성있게 감소시킴을 보여주고 있다(Fig. 2A, B).
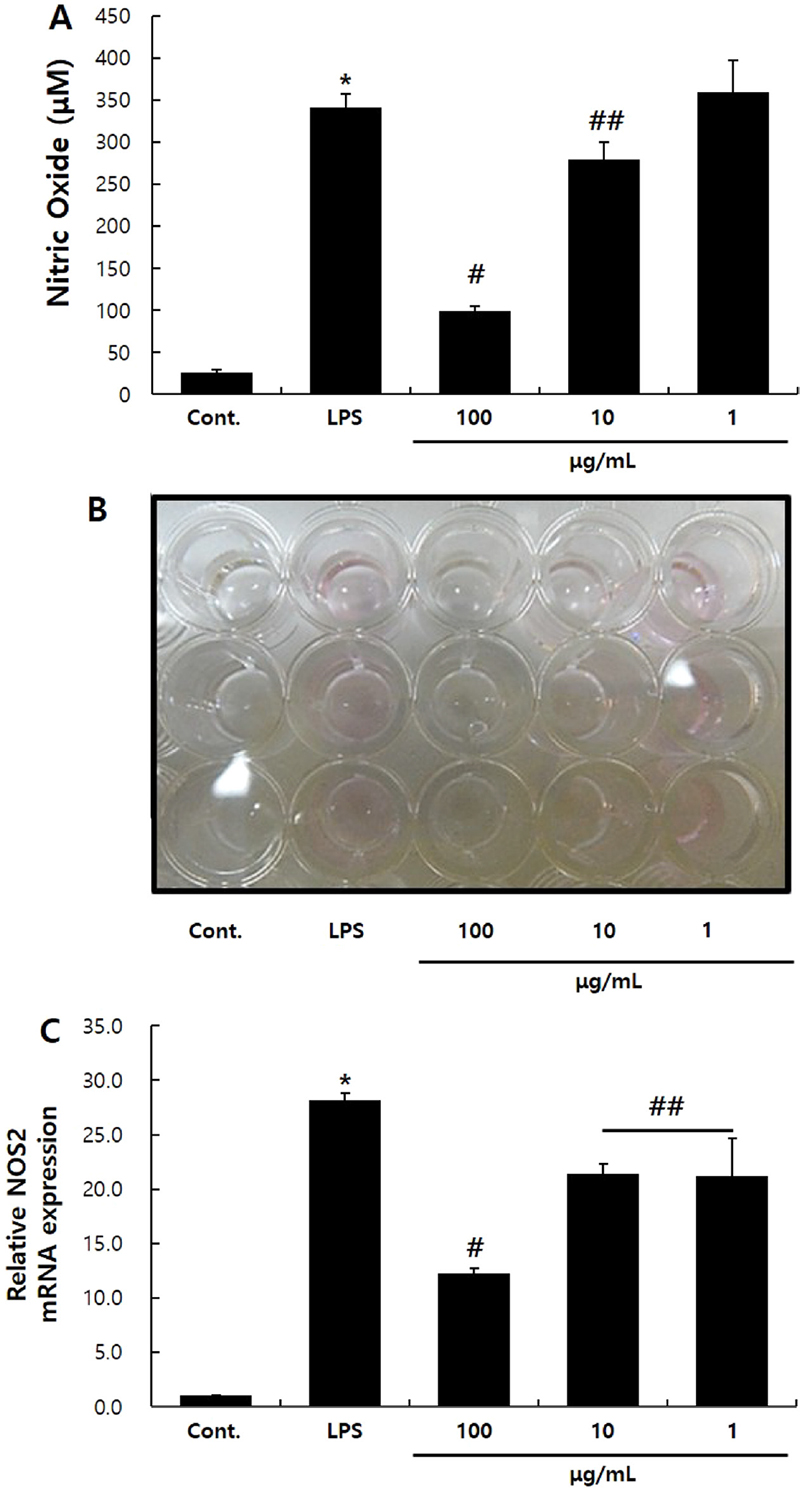
Effects of L. yamadae extract on NO production on RAW 264.7 cells. Cells were plated in 6-well culture plates and treated with L. yamadae extract for 72 h. The culture media were then collected and analyzed for nitric oxide (NO) production using a NO detection kit (A). Cells were treated with L. yamadae extract for 24 h. Real-time RT-qPCR was performed to assess the expression of the NOS2 mRNA (B). The data are showed as the mean ± S.D. from three independent experiments. Statistical significance is indicated as * compared to the control and # compared to the LPS-treated group; *,#p<0.01, ## p<0.05.
박테리아의 세포벽 성분인 LPS는 대식세포에서 NOS2의 발현을 유도하고, NO의 생성을 유발한다.13)L. yamadae 추출물이 NO의 생성을 유의성있게 감소시킨 결과가 NOS2 유전자의 발현과도 상관관계가 있는지를 확인하고자 Real-time RT-qPCR로 확인하였다. 대조군에 비해 LPS 처리군에서 NOS2 유전자의 발현이 유의성있게 증가하였으나, 100, 10, 1 μg/mL의 L. yamadae 추출물을 각각 처리한 실험군에서 NOS2의 발현이 유의성있게 감소함을 확인할 수 있었다(Fig. 2B).
L. yamadae 추출물이 PGE2의 생성에 끼치는 영향 -Prostaglandin (PG)는 아라키돈산 유래의 불포화지방산으로 염증을 유발하는 호르몬이다.14) PGE2는 아라키돈산으로부터 cyclooxygenase-2 (COX-2) 효소와 PGE synthase 1,2,3의 순차적인 대사과정에 의해 만들어진다.13,15) PGE2는 포유류의 피부에서 발견되는 PG 중에 주요한 인자로 알려져 있기 때문에 PGE2의 생성을 확인하고자 하였다.16)L. yamadae 추출물의 항염 효능을 확인하기 위하여 PGE2의 생성량을 확인하였을 때, LPS 처리군에서 PGE2의 생성이 19.9 ± 3.0 μg/mL로 대조군 대비 유의성있게 증가하였다. 100 μg/mL의 L. yamadae 추출물을 처리하였을 때에는 PGE2의 생성이 12.08 ± 2.1 μg/mL로 유의성있게 감소하였다(Fig. 3A). 또한 Real-time RT-qPCR로 COX-2 유전자의 발현을 확인한 결과, LPS 처리군에서 대조군 대비 2.4배 증가하였으나 100 μg/mL의 L. yamadae 추출물을 처리한 실험군에서는 LPS 처리군 대비 34% 감소하였다(Fig. 3B).
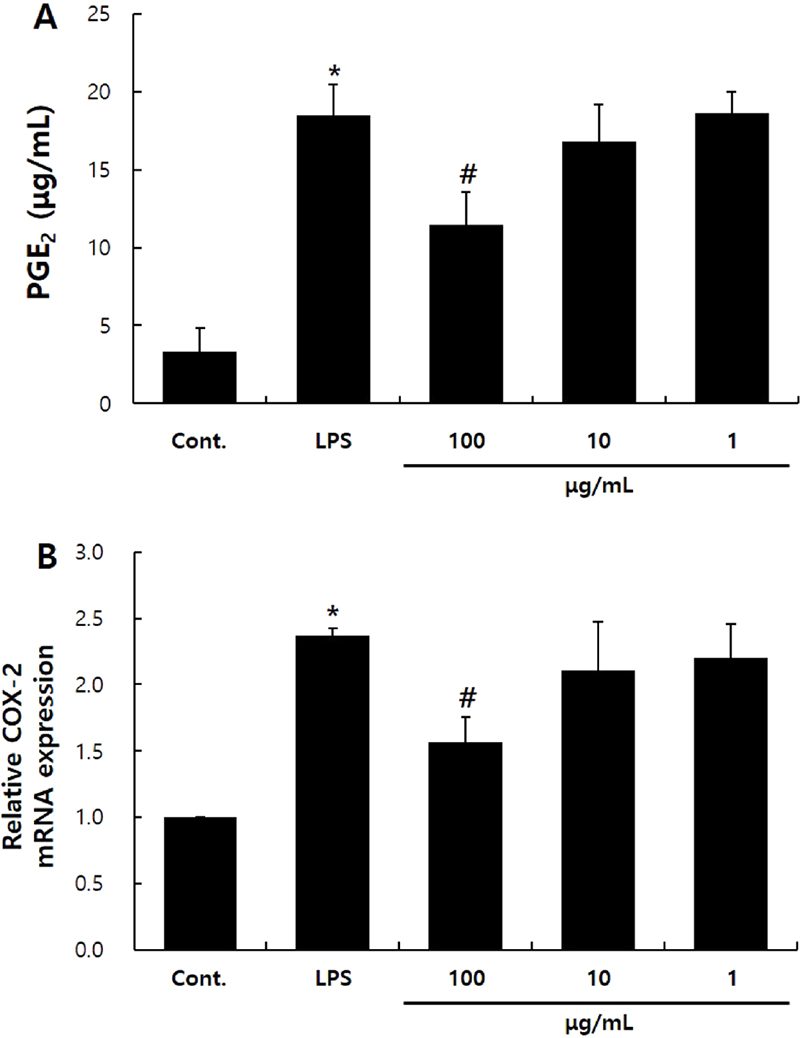
Effects of L. yamadae extract on PGE2 synthesis in RAW 264.7 cells. Cells were cultured in 6-well plates and treated with L. yamadae extract for 6 h. The supernatants were analyzed for PGE2 using a PGE2-ELISA (A). Cells were treated with L. yamadae extract for 24 h. Real-time RT-qPCR was performed to analyze the expression of the COX-2 mRNA (B). The data are expressed as the mean ± S.D. from three independent experiments. Statistical significance is denoted as * for comparison with the control and # for comparison with the LPS-treated group; * p<0.01, # p<0.05.
L. yamadae 추출물과 염증성 사이토카인 발현과의 관계 -피부의 만성적인 염증은 피부의 노화를 유발할 수 있다.12,17,18) IL-1α와 IL-1β는 면역반응, 조혈 및 염증과정을 유발하는 사이토카인으로, 대식세포 및 후천성 면역을 관장하는 형질세포 등에서 생성되는 강력한 염증성 사이토카인이다.19,20) 특별히 IL-1β는 염증부위로 호중구와 림프구 등의 염증매개세포의 침윤을 유발하는 사이토카인으로 알려져 있다.21,22) IL-6는 형질세포가 항원에 특이적으로 반응할 수 있도록 B세포로의 성숙과 성장을 유도하고, 알러지 등의 염증반응을 유발한다고 알려져 있다.5,12) 또한 TNF-α는 염증 초기단계에서 감염부위로 호중구를 불러들여 급성 면역반응에 의한 발열과 부종을 유발한다.23)
본 실험에서 사용된 LPS는 RAW 264.7세포에서 다양한 인터류킨과 TNF-α 등의 염증성 사이토카인인 발현을 유발한다. 본 실험에서는 LPS (100 ng/mL)로 RAW 264.7대식세포주에 염증반응을 유발한 후, L. yamadae 추출물에 의한 염증성 사이토카인 감소여부를 Real-time RT-qPCR로 확인하였다. IL-1α는 LPS에 의해 11.47배 증가하였으나 100, 10, 1 μg/mL의 L. yamadae 추출물에 의해 각각 82, 30, 13% 가량 발현이 감소하였다(Fig. 4A). IL-1β의 발현 정도는 LPS에 의해 12.6배 증가하였으나 100, 10 μg/mL농도의 L. yamadae 추출물을 처리한 결과, 각각 91, 23% 감소하였다(Fig. 4B). IL-6는 LPS에 의해 48배 증가하였는데, L. yamadae 추출물을 처리하였을 때 각각 94, 34% 가량 발현이 감소하였다(Fig. 4C). TNF-α의 발현량은 LPS 처리에 의해 5.26배 증가하였으나 100 μg/mL농도의 L. yamadae 추출물에 의해 43% 가량 감소하였다(Fig. 4D). 본 연구에서 L. yamadae 추출물이 염증에 관여하는 유전자인 인터류킨과 TNF-α의 발현을 감소시켰고, NO 및 PGE2의 생성을 감소시킴을 통해 항염 효과가 있음을 확인하였다. 이는 L. yamadae 추출물이 염증 반응을 감소시킬 수 있는 기능성 소재로서 활용될 수 있음을 보여준다. 특별히 Fig. 3과 Fig. 4D에서 보여주듯이 100 μg/mL농도의 L. yamadae 추출물이 RAW 264.7 세포의 PGE2의 생성과 TNF-α의 발현을 유의성있게 감소시키는 특이적인 농도로 보이며, 염증 치료제 등의 조성에 적절하게 사용할 수 있을 것이다.
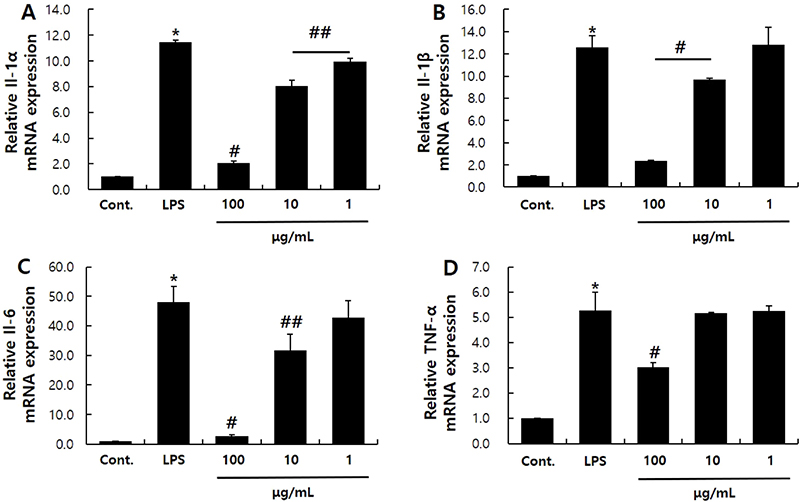
Effects of L. yamadae extract on the expression of inflammatory cytokines. Real-time RT-qPCR was performed to analyze the expression of inflammatory cytokines, including IL-1α (A), IL-1β (B), IL-6 (C), and TNF-α (D). These results are presented as the mean ± S.D. from three independent experiments. Statistical significance is indicated by * for comparison with the control and # for comparison with the LPS-treated condition; *, # p<0.01, ## p<0.05.
결 론
피부는 노화에 의해 탄력을 잃고 주름이 생성되고 염증반응 등이 자주 나타나게 된다. 외부 자극인자인 자외선과 담배연기, 미세먼지, 세균 등에 의해 피부는 프리라디컬과 NO 가스 등의 과도한 생성과 그 들의 연쇄 반응을 통해 노화가 더욱 심화된다.24,25) 또한 노화는 정상적인 세포의 감소, 세포의 기능저하에 의한 정상조직으로의 재생이 약화된다.26,27)
본 연구에서는 L. yamadae 추출물이 염증을 완화시킬 수 있는 소재로의 가능성을 확인해 보고자 하였다. Lesleigha yamadae 추출물이 대식세포의 생존률에 영향을 미치지 않으며, RAW 264.7 세포에 처리할 수 있는 적정 농도를 확인하였다(Fig. 1). 100 μg/mL 이하의 L. yamadae 추출물이 RAW 264.7 세포의 생존률에 영향을 끼치지 않았다. Real-time RT-qPCR을 통한 NOS2, COX-2, IL-1α/β, IL-6, TNF-α의 상대적 발현, PGE2 호르몬 생성, NO 생성량 측정에서 L. yamadae 추출물이 LPS에 의해 증가된 염증인자의 발현 및 생성을 유의성있게 감소시킴을 확인하였다(Fig. 2-4). 이는 L. yamadae 추출물이 염증을 개선시킬 수 있는 가능성을 제시한다.
L. yamadae 추출물이 염증을 완화할 수 있는 가능성을 보여준 최초의 연구이며, 추후 기능성화장품 혹은 염증 치료제의 소재로 활용될 수 있는 가능성을 확인할 수 있었다. 또한 향후 L. yamadae 추출물이 세포 내 신호전달기전에 의해 염증을 개선하는지에 대해 추가적인 세포 내부 및 외부 신호 관련 연구, 항염효과를 나타내는 L. yamadae 추출물 내 지표물질의 발굴 및 임상연구의 필요성이 있을 것으로 사료된다.
Acknowledgments
이 논문은 서울여자대학교 학술연구비의 지원에 의한 것임(2025-0027).
References
-
Ferrero-Miliani, L., Nielsen, O. H., Andersen, P. S. and Girardin, S. E. (2007) Chronic inflammation: importance of NOD2 and NALP3 in interleukin-1b generation. Clin. Exp. Immunol. 147: 227-235.
[https://doi.org/10.1111/j.1365-2249.2006.03261.x]

-
Akira, S. and Takeda, K. (2004) Toll-like receptor signaling. Nat. Rev. Immunol. 4: 499-511.
[https://doi.org/10.1038/nri1391]

-
Gomez, P. F., Pilllinger, M. H., Attur, M., Marjanovic, N., Dave, M., Park, J., Binagham, C., Al Mussawi, H. and Abramson, S. B. (2005) Resolution of inflammation:prostaglandin E2 dissociates nuclear trafficking of individual NF-kappa B subunits (p65, p50) in stimulated rheumatoid synovial fibroblasts. J. Immunol.175: 6924-6930.
[https://doi.org/10.4049/jimmunol.175.10.6924]

-
Horwood, N. J., Page, T. H., McDaid, J. P., Palmer, C. D., Campbell, J., Mahon, T., Brennan, F. N., Webster, D. and Foxwell, B. M. (2006) Bruton's tyrosine kinase is required for TLR2 and TLR4-induced TNF, but not IL-6, production. J. Immunol. 176: 3635-3641.
[https://doi.org/10.4049/jimmunol.176.6.3635]

-
Hirohashi, N. and Morrison, D. C. (1996) Low-dose lipopolysaccharide (LPS) pretreatment of mouse macrophages modulates LPS-dependent interleukin-6 production in vitro. Infect. Immun.64: 1011-1015.
[https://doi.org/10.1128/iai.64.3.1011-1015.1996]

-
Kim, S., Kang, B. Y., Cho, S. Y., Sung, D. S., Chang, H. K., Yeom, M. H., Kim, D. H., Sim, Y. C. and Lee, Y. S. (2004) Compound K induces expression of hyaluronan synthase 2 gene in transformed human keratinocytes and increases hyaluronan in hairless mouse skin. Biochem. Biophys. Res. Commun. 316: 348-355.
[https://doi.org/10.1016/j.bbrc.2004.02.046]

-
Gabay, C. (2006) Interleukin-6 and chronic inflammation. Arthritis Res. Ther. 8: S3.
[https://doi.org/10.1186/ar1917]

-
van Triel, J. J., Arts, J. H. E., Hans, M. and Kuper, C. F. (2010) Allergic inflammation in the upper respiratory tract of the rat upon repeated inhalation exposure to the contact allergen dinitrochlorobenzene (DNCB). Toxicology269: 73-80.
[https://doi.org/10.1016/j.tox.2010.01.008]

- Im, D. Y. (2014) Volatile compounds analysis of the extract from dried bark of Prunus sargentii and physiological activity of the main compound, benzaldehyde. Kor. J. Aesthetics Cosmetol.12: 155-162.
- Segawa, S. (1938) On the marine algae of Susaki, Prov. Izu, and its vicinity, III. Scientific Papers of the Institute of Algological Research, Faculty of Science, Hokkaido Imperial University 2: 131-153, 11 figs, plates 32-36.
-
Lawrence, T., Willoughby, D. A. and Gilroy, D. W. (2002) Anti-inflammatory lipid mediators and insights into the resolution of inflammation. Nat. Reviews Immunol.2: 787-795.
[https://doi.org/10.1038/nri915]

-
Lee, H. J., Sim, B. Y., Bak, J. W. and Kim, D. H. (2014) Effect of Gami-sopungsan on inflammation and DNCB-induced dermatitis in NC/Nga in mice. Kor. J. Orient. Physiol. Pathol.28: 146-153.
[https://doi.org/10.15188/kjopp.2014.04.28.2.146]

-
Namazi, M. R. (2004) Cetirizine and allopurinol as novel weapons against cellular autoimmune disorders. Int. Immunopharmacol.4: 349-353.
[https://doi.org/10.1016/j.intimp.2004.01.022]

-
Yun, K. J., Kim, J. Y., Kim, J. B., Lee, K. W., Jeong, S. Y., Park, H. J., Jung, H. J., Cho, Y. W., Yun, K. J. and Lee, K. T. (2008) Inhibition of LPS-induced NO and PGE2 production by Asiatic acid via NF-kB inactivation in RAW 2264.7 macrophages: Possible involvement of the IKK and MAPK pathways. Int. Immunopharmacol.8: 431-441.
[https://doi.org/10.1016/j.intimp.2007.11.003]

-
Harris, S. G., Padilla, J., Koumas, L., Ray, D. and Phipps, R. P. (2002) Prostaglandins as modulators of immunity. Trends Immunol.23: 144-150.
[https://doi.org/10.1016/S1471-4906(01)02154-8]

-
Li, Y., Lei, D., Swindell, W. R., Xia, W., Weng, S., Fu, J., Worthen, C. A., Okubo, T., Johnston, A., Gudjonsson, J. E., Voorhees, J. J. and Fisher, G. J. (2015) Age-associated increase in skin fibroblast-derived prostaglandin E2 contributes to reduced collagen levels in elderly human skin. J. Invest. Dermatol. 135: 2181-2188.
[https://doi.org/10.1038/jid.2015.157]

-
Abu, S. M., Noman, N. K., Ferdaus, H., Imtiaz, I. E. K., Jargalsaikhan, D., Gantsetseg, T., Shamima, I., Yoshikazu, N., Tomoaki, Y. and Takashi, Y. (2009) Thalidomide inhibits lipopolysaccharide-induced tumor necrosis factor-a production via down-regulation of MyD88 expression. Innate Immun.15: 33-41.
[https://doi.org/10.1177/1753425908099317]

- Shon, M. S., Song, J. H., Kim, J. S., Jang, H. D. and Kim, G. N. (2013) Anti-oxidant activity of oil extracted from Korean red ginseng and its moisturizing function. Kor. J. Aesth. Cosmetol.11: 489-494.
-
Lord, P. C., Wilmoth, L. M., Mizel, S. B. and McCal, C. E. (1991) Expression of interleukin-1 alpha and beta genes by human blood polymorphonuclear leukocytes. J. Clin. Invest.87: 1312-1321.
[https://doi.org/10.1172/JCI115134]

-
Ban, J. Y., Kim, B. S., Kim, S. C., Kim, D. H. and Chung, J. H. (2011) Microarray analysis of gene expression profiles in response to treatment with melatonin in lipopolysaccharide activated RAW 264.7 cells. Kor. J. Physiol. Pharmacol. 15: 23-29.
[https://doi.org/10.4196/kjpp.2011.15.1.23]

- Roitt, I., Brostoff, J. and Male, D. (2002) Immunology sixth edition, London Mosby, p119, 128, 441.
- Baek, Y. M., Choi, J. Y., Lee, C. W., Jeon, Y. S., Han, J. T., Jang, S. I. and Yoo, H. S. (2012) Effects of Chinemys reevesii on lipopolysaccaride-indused inflammatory reactions. Kor. J. Orient. Physiol. Pathol.26: 26-34.
-
Zhang, Y., Ramos, B. F. and Jakschik, B. A. (1992) Neutrophil recruitment by tumor necrosis factor from mast cells in immune complex peritonitis. Science258: 1957-1959.
[https://doi.org/10.1126/science.1470922]

-
Talwar, H. S., Griffiths, C. E., Fisher, G. J., Hamilton, T. A. and Voorhees, J. J. (1995) Reduced type I and type III procollagens in photodamaged adult human skin. J. Invest. Dermatol.105: 285-290.
[https://doi.org/10.1111/1523-1747.ep12318471]

-
Kim, J., Lee, C. W., Kim, E. K., Lee, S. J., Park, N. H., Kim, H. S., Kim, H. K., Char, K., Jang, Y. P. and Kim, J. W. (2011) Inhibition effect of Gynura procumbens extract on UV-B-induced matrix-metalloproteinase expression in human dermal fibroblasts. J. Enthnopharmacol.137: 427-433.
[https://doi.org/10.1016/j.jep.2011.04.072]

-
Kirkwood, T. B. (2005) Understanding the odd science of aging. Cell120: 437-447.
[https://doi.org/10.1016/j.cell.2005.01.027]

-
Jones, D. L. and Rando, T. A. (2011) Emerging models and paradigms for stem cell ageing. Nat. Cell Biol.13: 506-512.
[https://doi.org/10.1038/ncb0511-506]

