
HPLC-PDA를 이용한 한약제제 지표성분 12종 다성분 동시분석법 확립
Correspondence to: *(E-mail): rain01@korea.kr (Tel) : +82-43-719-4801
Abstract
Traditional Korean medicinal product consists of various traditional Korean medicines. Identification and assay are performed to confirm quality of traditional Korean medicinal product. Currently, assay of traditional Korean medicinal product requires a lot of analysis time due to an individual ingredient-specific pretreatment process. So it is necessary to improve it for reasonable quality control in pharmaceutical industry. In this study, we’ve focused on development of the simultaneous assay method with 12 marker compounds, which is applicable to every 87 traditional Korean medicinal products whose dosage form is ‘extract granules’, listed in the Korean Pharmacopoeia (KP) and the Korean Herbal Pharmacopoeia (KHP). The 12 characterizing compounds were amygdalin, geniposide, puerarin, paeoniflorin, hesperidin, 6,7-dimethylesculetin (scoparone), baicalin, berberine hydrochloride, cinnamic acid, paeonol, glycyrrhizic acid and schizandrin. We performed the validation and confirmed linearity, limit of detection, limit of quantitation, accuracy and precision. The R² value of linearity for characterizing compounds was ≥ 0.99, respectively. And the recovery rate was 80~120%, and the RSD was 15% or less. Also, it was confirmed that the contents of characterzing compound were similar comparing newly-developed test method to current test method. As a result, the developed simultaneous analysis methods have been reflected in Korean Herbal Pharmacopoeia and used for the quality control of traditional Korean medicinal products.
Keywords:
The korean herbal pharmacopoeia, Herbal medicinal products, HPLC-DAD, Simultaneous analysis method, Validation대한민국약전 및 대한민국약전외한약(생약)규격집에 수재된 한약(생약)제제는 가미소요산엑스과립 등 총 314품목으로,1,2) 다양한 화합물로 구성되어 성분 전체에 대한 화학적 구조 및 성질을 완전히 규명하는데 어려움이 있어3-5) 구성 생약 중 일부 생약에 대하여 지표물질의 정량 기준을 설정하고 이를 품질관리의 지표로 활용하고 있다.5-7) 또한 여러 구성 생약의 복합제에서 개별 지표 물질의 정량을 일일이 수행해야 하는 측면에서 시간적, 경제적 어려움이 발생한다.3-5) 따라서 한약(생약)제제의 효율적인 품질관리를 위해 제제를 구성하는 생약의 지표성분을 동시분석할 수 있는 동시분석법 개발이 필요하다. 이에 본 연구에서는 HPLC-PDA법을 이용하여 동시분석법을 개발하고자 하였다. 대한민국약전외한약(생약)규격집 생약시험법에는 32개의 원생약에 대한 함량시험법이 설정되어있고, 그 중 갈근(葛根, Pueraria Root), 감초(甘草, Licorice), 계지(桂枝, Cinnamomi Ramulus), 육계(肉桂, Cinnamon Bark), 도인(桃仁, Peach Kernel), 행인(杏仁, Apricot Kernel), 목단피(牧丹皮, Moutan Root Bark), 오미자(五味子, Schisandra Fruit), 인진호(茵蔯蒿, Artemisiae Capillaris Herba), 작약(芍藥, Peony Root), 진피(陳皮, Citrus Unshiu Peel), 치자(梔子, Gardenia Fruit), 두충(杜仲, Eucommia Bark), 황금(黃芩, Scutellaria Root), 황련(黃連, Coptis Rhizome), 황백(黃柏, Phellodendron Bark) 총 16품목이 한약(생약)제제에 많이 활용되고 있다. 따라서 각 한약(생약)의 지표성분인 amygdalin (도인·행인), geniposide (두충·치자), puerarin (갈근), paeoniflorin (목단피·작약), hesperidin (진피), 6,7-dimethylesculetin (scoparone, 인진호), baicalin (황금), berberine hydrochloride (황련·황백), cinnamic acid (계지·육계), paeonol (목단피), glycyrrhizic acid (감초), schizandrin (오미자) 등 지표성분 12종 동시분석법을 개발하였다. 확립된 시험법에 대하여 식품의약품안전처에서 제시하고 있는 의약품등 시험방법 밸리데이션 밸리데이션 가이드라인 및 AOAC 가이드라인에 따라 직선성, 특이성, 정밀성, 정확성, 검출한계, 정량한계, 시스템적합성 평가를 수행하여 시험법의 타당성을 검토하였다. 또한 확립된 분석법을 이용하여 시중에 유통되는 과립제의 함량을 분석하여 본 분석법의 응용가능성을 검토하였다.
재료 및 방법
시약 및 표준물질-HPLC 분석을 위한 water와 acetonitrile은 Merck사의 HPLC급 용매를 구입하였고, phosphoric acid는 Sigma aldrich사의 ACS급 용매를 구입하여 사용하였다. 지표물질인 amygdalin, geniposide, puerarin, paeoniflorin, hesperidin, scoparone, baicalin, berberine hydrochloride, cinnamic acid, paeonol, glycyrrhizic acid, schizandrin은 Chemfaces사에서 순도 98% 이상인 표준품을 구입하였으며, 이들의 화학적 구조는 Fig. 1과 같다.
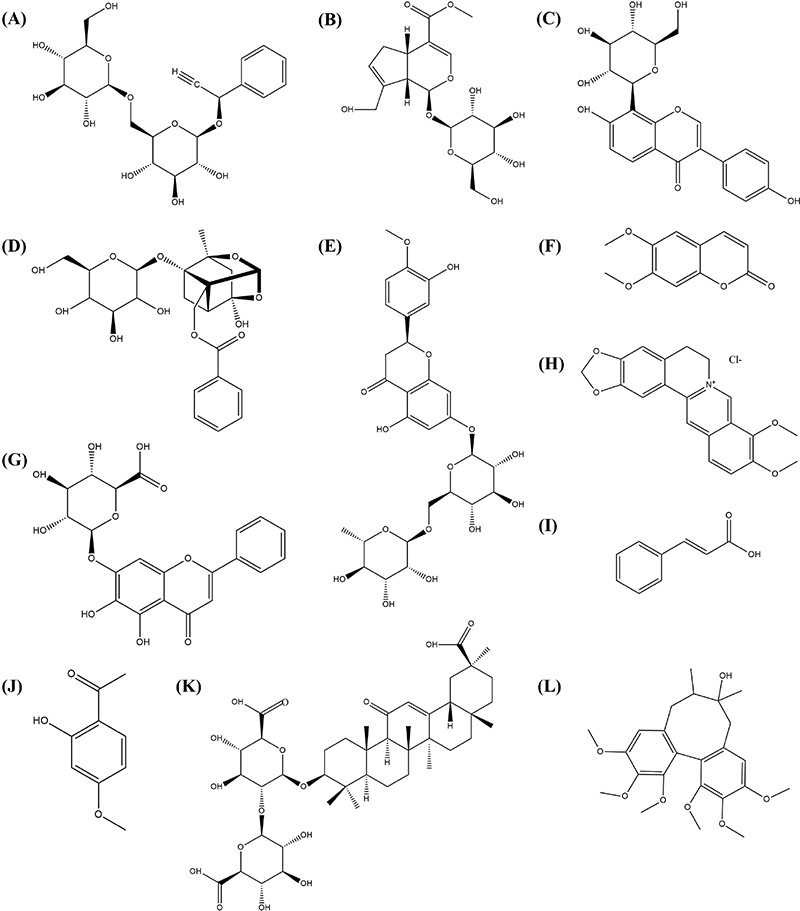
Chemical structures of (A) amygdalin, (B) geniposide, (C) puerarin, (D) paeoniflorin, (E) hesperidin, (F) 6,7-dimethylesculetin(scoparone), (G) baicalin, (H) berberine hydrochloride, (I) cinnamic acid, (J) paeonol, (K) glycyrrhizicacid, (L) schizandrin.
표준액조제 –amygdalin, geniposide, puerarin, paeoniflorin, hesperidin, scoparone, baicalin, berberine hydrochloride, cinnamic acid, paeonol, glycyrrhizic acid, schizandrin은 각각 200 mg씩 정밀히 칭량하여 methanol 10 mL로 녹여 20,000 ㎍/mL의 농도로 표준원액을 제조하였다. 각 표준원액 2.5 mL (amygdalin 표준원액 7.5 mL)씩 정확하게 취하여 methanol 50 mL로 맞추어 1,000 ㎍/mL (amygdalin 3,000 ㎍/mL) 농도를 단계적으로 희석하여 직선성 표준용액으로 사용하였다.
검액제조- 본 연구에 사용한 과립제는 시중에 판매하고 있는 제제를 구입하여 사용하였으며, Table I에 나타내었다. 제제의 1회량을 50 mL 코니칼튜브에 정밀히 취한 다음 50% methanol 40 mL를 넣고 30분간 초음파 추출한 후 여과지(Whatman, Grade 4, Φ 90 mm)를 사용하여 여과하고 다시 50% methanol을 넣어 정확하게 100 mL로 정용한 뒤 검액으로 사용하였다.
HPLC 분석조건 – HPLC는 Agilent 1260 infinity (Agilent, Santa, CA, USA)를 사용하였고 컬럼은 YMC Pack ODS-A (250×4.6 mm, 5 μm)을 사용하였다. 이동상은 0.05% phosphoric acid를 포함한 water (A)와 acetonitrile (B)를 사용하여 지표성분의 12종 동시분석법에 대한 최적의 gradient 조건을 확립하였다(Table 2). 확립된 분석법에 따라 검액 10 μL 주입하여 1.0 mL/min 유속으로 230 nm (PDA) 파장에서 분석하였다.
확립된 분석법의 검증(Validation) – 한약(생약)제제에 대한 12종 지표성분 동시분석법의 유효성을 검증하기 위하여 ‘의약품등 시험방법 밸리데이션 가이드라인’ 및 ‘AOAC 밸리데이션 가이드라인’을 참고하여 직선성, 특이성, 정밀성, 정확성, 검출한계, 정량한계 및 시스템적합성 항목을 검토하였다.
직선성(Linearity) – 12종 지표성분의 표준품을 각 농도별로 희석하여 농도가 다른 6개 표준용액을 가지고 실험하였다. 이때, 검량선(y=ax+b, y와 x는 각각 peak의 면적과 시료의 함량)을 이용하여 결정계수(R2)의 값을 통해 직선성을 판단하였으며, R2의 값이 0.99 이상일 때, 지표성분의 함량을 평가하는 검량선으로 사용하였다.
특이성(Specificity) – 12종 지표성분을 혼합한 표준액을 제조하여 matrix와 분리되고 구별되었는지 PDA 검출기를 이용하여 스펙트럼과 분리도를 확인하였다.
검출한계(Limit of Detection), 정량한계(Limit of Quantitation) -검출한계 및 정량한계는 반응의 표준편차와 검량선의 기울기에 근거하는 방법으로 산출되었으며, 검량선을 3회 반복하여 얻은 기울기의 평균(S)과 표준편차(σ)를 아래의 수식을 사용해 계산하였다.
검출한계(LOD) = 3.3 × σ / S
정량한계(LOQ) = 10 × σ / S
σ : 반응의 표준편차, S : 검량선의 기울기
정확성(Accuracy), 정밀성(Precision) – 정확성과 정밀성 평가를 위해 사용한 검액은 동일한 방법으로 제조하여 각 지표성분의 피크면적 값을 비교하는 방법으로 측정하였다. 아미그달린, 글리시리진산, 패오니플로린 및 바이칼린 평가용 검액은 패독산을 시료로 하여 3가지 농도로 희석한 혼합표준액을 처리한 다음, 50% 메탄올에 추출해 검액으로 사용하였다. 베르베린, 게니포시드, 헤스페리딘, 쉬잔드린, 패오놀, 신남산, 푸에라린, 디메틸에스쿨레틴 검액은 작약감초탕을 동일한 방법으로 제조하여 검액으로 사용하였다.

The linearity, determination coefficient (R2), limit of detection (LOD) and limit of quantification (LOQ) of compounds studied
정확성은 3가지 농도의 혼합표준액을 첨가한 검액을 3회 반복 실험하여 회수율(Recovery)과 상대표준편차(% RSD)를 측정하는 방법으로 평가하였다.
정밀성은 동일한 방법으로 조제된 검액을 intra-day test를 통해 각 농도별로 3회 반복 측정한 결과의 상대표준편차(% RSD)를 산출하고 inter-day test를 통해 3일간 반복 실험하여 측정한 검액 농도의 상대표준편차(% RSD)를 산출하여 정밀성을 확인하였다.
시스템 적합성(System Suitability) - 시스템 적합성은 분석기기, 분석조작, 분석대상검체 등으로 구성된 전체 시스템이 적절하게 가동되는지 증명하기 위한 것으로 혼합된 표준액을 9회 조제하여 측정하고 각 지표성분의 피크면적에 대한 상대표준편차(% RSD)를 확인하여 시스템 재현성을 증명하였다.
확립된 동시분석법을과립제함량평가– 확립된 분석법의 적용성을 평가하기 위해 시중에서 판매되는 과립제 39종에 대해 각각 2종 이상 확보하여 지표성분 함량을 평가하였다.
결과 및 고찰
분석조건의 확립 – 12종 지표성분 동시분석법을 확립하기 위해 용매 조성 비율 및 파장을 검토하여 분석조건을 확립하였다. 이동상은 0.05% phosphoric acid를 포함한 water와 acetonitrile으로 구성하고, 용매 조성 비율을 시간대 별로 달리하여 분리능을 높인 gradient 조건으로 설정하였다(Table 2). PDA detector의 파장 조건은 각 지표성분의 최대 흡수파장을 고려하여 12종 지표성분을 모두 검출할 수 있는 230 nm로 측정파장을 확립하였다(Fig. 2). 지표성분의 peak는 유지시간과 UV 스펙트럼을 비교하여 확인하였다.
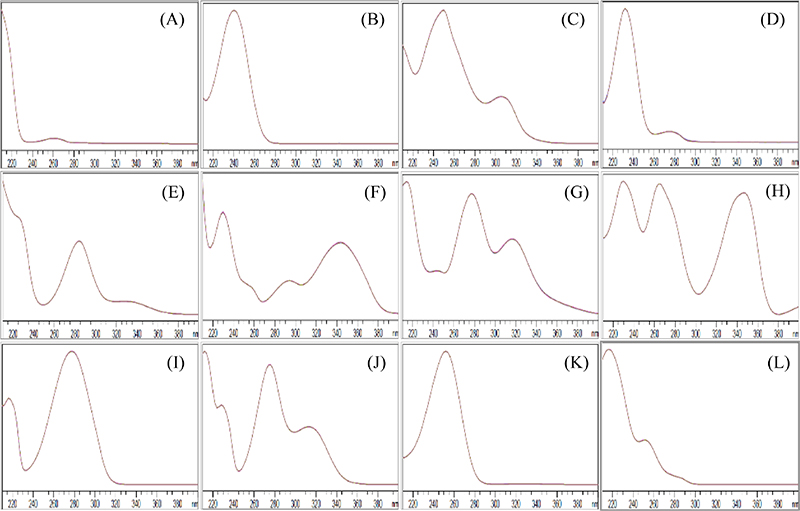
UV spectra of (A) amygdalin, (B) geniposide, (C) puerarin, (D) paeoniflorin, (E) hesperidin, (F) 6,7-dimethylesculetin (scoparone), (G) baicalin, (H) berberinehydrochloride, (I) cinnamic acid, (J) paeonol, (K) glycyrrhizicacid, (L) schizandrin.
동시분석법밸리데이션 -확립된 동시분석법에 대한 밸리데이션은 의약품등 분석법의 밸리데이션에 대한 가이드라인에 따라 직선성, 검출한계, 정량한계를 평가하였다.
직선성(Linearity),검출한계(LOD),정량한계(LOQ) – 12종 지표성분의 표준용액을 6가지 농도 (1 ㎍/mL, 3 ㎍/mL, 5 ㎍/mL, 10 ㎍/mL, 25 ㎍/mL, 50 ㎍/mL)로 희석하여 HPLC 분석을 3회 반복 실시하였다. 분석 결과에 따라 y축을 피크면적, x축을 표준용액의 농도로 하여 y=ax+b 형태의 검량선을 작성하였다. 작성된 검량선을 통해 12종 지표성분의 R2 값은 모두 0.9982 이상으로 좋은 직선성을 보였다(Tabel 3). 검량선을 분석하여 얻은 표준편차값과 기울기를 이용하여 지표성분에 대한 검출한계(LOD) 및 정량한계(LOQ)를 산출한 결과, 12종 지표성분의 LOD는 0.16~2.13 ㎍/mL로 측정되었고, LOQ는 0.52~6.47 ㎍/mL로 측정되었다(Table 5).
정확성(Accuracy) 및 정밀성(Precision) – 동시분석법의 정확성을 검토하기 위해 회수율 및 상대표준편차(% RSD)를 확인한 결과, 회수율은 83.36~108.85%의 범위로, 상대표준편차(% RSD)는 15% 이하로 확인되어 정확성이 확보되었다(Tabel 4). 또한, 정밀성 평가를 위해 intra-day test와 inter-day test를 실시하여 상대표준편차를 확인한 결과, Intra-day test에서는 상대표준편차(% RSD)가 0.10~7.34%의 범위를 나타내었으며, Inter-day test는 상대표준편차(% RSD)가 0.58~13.78%로 확인되어 정밀성을 확보하였다(Table 4). 정밀성과 정확성은 모두 식품의약품안전처 ‘의약품 등 시험방법 밸리데이션 가이드라인’ 및 ‘AOAC 밸리데이션 가이드라인’을 만족하였다.
시스템적합성(System Suitability)– 12종 지표성분에 대하여 동시정량법의 시스템 적합성을 검토하기 위하여 혼합표준액을 9회 조제하여 피크면적을 측정하였다. 측정된 각 지표성분의 피크면적에 대한 상대표준편차(% RSD)는 1.5% 이하였으며, 확립된 분석법의 시스템이 적절함을 확인하였다(Table V).
확립된 분석법을 이용한 한약(생약)제제 함량분석 – 이와 같이 확립된 분석법을 이용하여 유통되고 있는 한약(생약)제제를 대상으로 12종 지표성분에 대한 함량분석을 수행하였다. 12종 지표성분들은 각각 다른 지표성분 및 matrix의 간섭을 받지 않았으며, 갈근탕가천궁신이엑스 과립, 패독산엑스 과립, 생강사심탕엑스 과립, 황금탕엑스 과립을 분석하였을 때 각각의 지표성분이 피크가 각기 다른 성분들의 피크에 영향을 받지 않고 분석이 가능함을 확인하였다(Fig. 3). 시판되는 과립제 39종에 대해 무작위로 2종류 이상을 구입해 분석한 결과, 모든 시판 제제에서 설정된 함량시험법 지표성분이 허가 기준 이상으로 적합하게 검출되었다(Tabel 6).
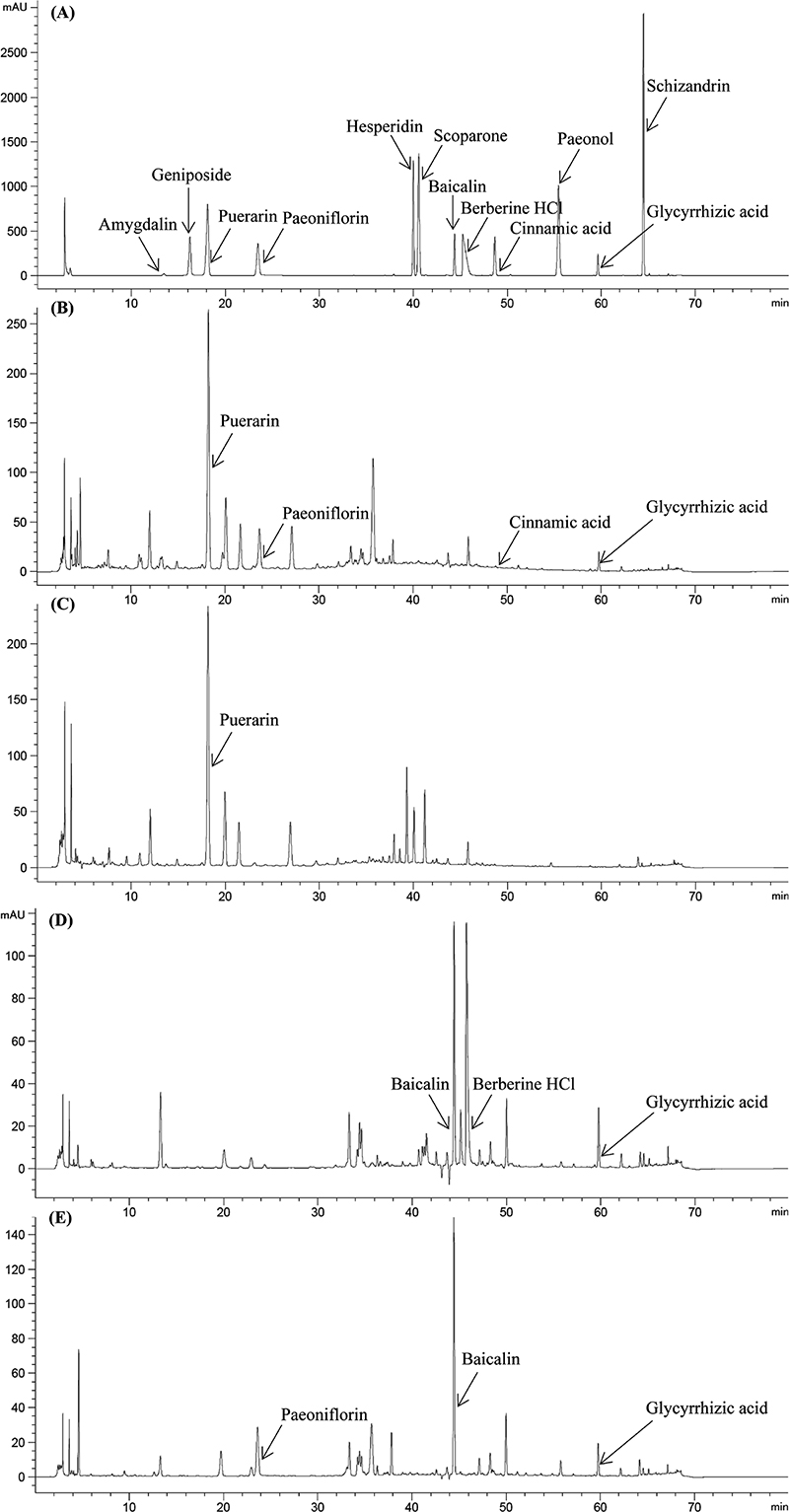
HPLC Chromatogram of the simultaneous analysis 1 method of (A) standard mixture, (B) Galgeuntanggacheongungsini extract granules, (C) Paedoksan extract granules, (D) Saenggangsasimtang extract granules, (E) Hwanggeumtang extract granules.
결 론
본 연구에서는 한약(생약)제제 중 12종 지표성분인 amygdalin, geniposide, puerarin, paeoniflorin, hesperidin, scoparone, baicalin, berberine hydrochloride, cinnamic acid, paeonol, glycyrrhizic acid, schizandrin을 동시 정량할 수 있는 동시분석법을 확립하였다. 이는 식품의약품안전처 ‘의약품등 시험방법 밸리데이션 가이드라인’ 및 ‘AOAC 밸리데이션 가이드라인’에 따라 동시분석법에 대한 특이성, 직선성, 정밀성, 정확성 및 시스템 적합성 항목을 검증하였다. 또한 시중에 유통되고 있는 한약(생약)제제를 대상으로 12종 지표성분과 matrix에 의한 간섭없이 효과적으로 분리 및 분석되는 것을 확인하였다. 개발된 분석법은 한약(생약)제제의 품질평가의 시간적, 경제적 손실을 줄이고, 12종 지표성분을 효율적으로 분석할 수 있는 방법으로 활용될 것으로 사료된다.
Acknowledgments
본 연구는 2024년도 식품의약품안전처의 연구개발비(22201MFDS144)로 수행되었으며 이에 감사드립니다.
References
- 식품의약품안전처. (2019) 대한민국약전 제12개정.
- 식품의약품안전처. (2021) 대한민국약전외한약(생약)규격집 제6개정.
- Yang, H. J., Weon, B. J., Ma, J. Y. and Ma, C. J. (2010) Simultaneous determination of six bioactive components in Guibi-tang by HPLC-DAD. Kor. J. Pharmacogn. 41: 313-318.
-
Lee, M. K., Park, J. H., Cho, J. H., Kim, D. H., Baek, J. H., Kim, H. J., Lee, K. Y., Kim, S. D., Kim, Y. C. and Sung, S. H. (2008) Simultaneous determination of hesperidin and glycyrrhizin in Pyungwi-san by HPLC/DAD. Kor. J. Pharmacogn. 39: 199-202.
[https://doi.org/10.4333/KPS.2009.39.1.023]

- Lee, B. H., Ma, J. Y., Weon, J. B., Yang, H. J., Yun B. R. and Ma, C. J. (2012) Simultaneous determination of three compounds in Ejung Tang by HPLC-DAD and LC-ESI-MS. Kor. J. Pharmacogn. 43: 10-15.
- Yoo, N. H., Kwon, Y. S. and Kim, M. J. (2019) Establishment of HPLC-UV analysis method validation for simultaneous analysis of standard compounds of Oplopanax elatus Nakai stem. Kor. J. Pharmacogn. 50: 133-140.
- Kang, K. B., Jun, J. B., Yoo, G. J., Kwon, E. A., Yun, J. W., Kang, B. C., Kim, S. H., Sung, S. H., Jang, Y. P. and Yang, H. J. (2017) Simultaneous determination of gastrodin and gastrodigenin in Gastrodia elata by HPLC-UV. Kor. J. Pharmacogn. 48: 232-236.