In-house library를 활용한 국내 약용 및 기능성 식물 대사체 글로벌 프로파일링
Abstract
Plants have been utilized as crucial raw materials for medicine development worldwide and consumed in the form of food or medicine due to their medicinal properties. Since medicinal efficacy of plants is derived from numerous bioactive metabolites synthesized within them, identifying metabolites present in specific plants is crucial. In this study, we conducted global metabolite profiling of medicinal and functional plants used in Korea, employing liquid chromatography-mass spectrometry (LC-MS). To enhance the reliability of metabolite identification, we constructed an in-house library containing 106 compounds and used it as a reference for the identification process. Additionally, to maximize the number of metabolites identified, we compared the extraction efficiency of dichloromethane, diethyl ether, 70% ethanol and methanol confirming that extraction using 70% ethanol and methanol was the most effective. Based on these findings, we conducted global metabolite profiling of 30 plant species, resulting in the detection of 309 metabolites.
Keywords:
Metabolomics, LC-MS, Phytochemical global profiling, In-house library, Medicinal and functional plant식물은 전 세계적으로 수천 년 동안 의약 개발의 핵심 원료로 활용되어 왔고 그 수는 약 500,000종에 달하며, 항암, 항당뇨, 항산화, 항노화, 항염증 등 다양한 임상적 효능을 지니고 있다.1-3) 국내의 경우 약 1,253종의 식물이 의약 목적으로 특정 질병의 예방, 치료 또는 건강 증진을 위해 사용되는 약용식물로 분류되어 있고, 약 826종이 식용식물로 분류되는데 여기에는 약용으로 분류되지는 않지만 건강 증진에 기여할 수 있는 특정 생리 활성 성분을 함유한 기능성 식물들이 포함된다.
식물의 의약학적 효능은 식물체 내에서 합성되는 수많은 생리 활성 대사체에서 비롯되는 것으로 알려져 있다. 평균적으로 한 개의 식물체는 약 5,000개의 대사체를 포함하고 있고 전체 식물계에서 만들어지는 대사체는 200,000-1,000,000개에 달하는데, 이들 중 상당수가 식물에서만 특이적으로 합성된다.4) 이러한 식물 대사체는 식물을 그 자체로 섭취하거나 반합성 과정의 원료로서 의약품 개발의 화학구조적 골격을 제공해 의약품의 형태로 복용할 때 체내로 유입되어 생리 활성을 나타낸다.5)
따라서 특정 식물 내에 존재하는 대사체를 확인하는 것은 해당 식물의 의약적 효능을 예측하여 천연물의약품으로서의 활용 가치를 판단하는 데에 있어 매우 중요하고, 이는 식물 대사체학(plant metabolomics)을 통해 실현 가능하다.6) 식물 대사체학은 식물체 내 다양하고 복잡한 대사체 풀의 구성을 파악할 수 있는 광범위하고 높은 감도의 실용적인 방법이다.7) 현재 다양한 분석 기술이 활용되고 있으며 특히 액체크로마토그래피-질량분석법(liquid chromatography-mass spectrometry, LC-MS), 기체크로마토그래피-질량분석법(gas chromatography-mass spectrometry, GC-MS), 핵자기 공명(nuclear magnetic resonance, NMR) 등을 통한 고차원적 대사체 프로파일링이 실시되고 있다. 다른 분석 기술에 비해 LC-MS는 식물의 1차 및 2차 대사체와 지질까지 광범위한 대사체를 비교적 가장 안정적으로 검출할 수 있다는 장점이 있다.8) 따라서 본 실험에서는 LC-MS를 기반으로 국내에서 사용되는 약용 또는 기능성 식물 대상 대사체 글로벌 프로파일링을 실시하였다. 가능한 많은 수의 대사체를 높은 신뢰도로 식별하기 위해 서로 다른 네 가지 추출용매를 사용해 추출을 진행한 후 그 효율을 비교하였고, 대사체학에 있어 가장 높은 신뢰도 단계인 Metabolomics Standards Initiative (MSI) level 1을 확보하고자 in-house library를 직접 제작하여 이를 기반으로 데이터를 분석하였다. 결과적으로 총 30종의 약용 및 기능성 식물 내 대사체 풀을 프로파일링 할 수 있었다.
재료 및 방법
실험재료 - 본 실험에서 사용된 30종 식물(갓, 개똥쑥, 겨자, 고사리, 곤드레, 곰취, 근대, 더덕, 돌나물, 모시풀, 민들레, 바디나물, 방아풀, 병풍쌈, 블루베리, 뽀리뱅이, 산마늘, 셀러리, 시금치, 쑥갓, 삼채, 양상추, 어수리, 연, 유채나물, 참나물, 케일, 콜라비, 헛개나무, 화살나무)은 모두 농촌진흥청(Rural development administration)으로부터 제공받았다. 각 식물은 서로 다른 부위를 건조 후 가공하여 분말 형태로 준비하였다. 겨자, 곤드레, 곰취, 모시풀, 방아풀, 병풍쌈, 뽀리뱅이, 산마늘, 쑥갓, 케일, 화살나무는 잎을, 갓, 개똥쑥, 근대, 시금치, 유채나물, 참나물은 잎줄기를, 헛개나무는 과병을, 블루베리는 열매를, 삼채, 더덕, 연은 뿌리를, 콜라비는 비대경을, 고사리, 돌나물, 바디나물은 순을, 민들레는 전초를, 셀러리, 양상추, 어수리는 전체를 사용하였다(Table 1). 추출에 사용하기 전까지 모든 식물의 건조 분말은 4℃에서 냉장보관하였다.
시약 및 기기 - 식물 대사체 프로파일링을 위해 초고성능 액체크로마토그래피(ultra performance liquid chromatography; UPLC) 기기로서 1290 Infinity II (Agilent Technologies, Santa Clara, CA, USA)를 사용하였고, 질량분석기(mass spectrometer, MS)는 6530 QTOF LC/MS (Agilent Technologies, Santa Clara, CA, USA)를 사용하였다. 분석용 컬럼은 Waters (Milford, MA, USA)사의 Acquity bridged ethyl hybrid C18 (1.7 μm, 2.1 mm × 100 mm)을 사용하였다. 분석용매로 사용한 water와 acetonitrile은 각각 MS grade와 LC grade를 J.T. Baker (Phillipsburg, NJ, USA) 사에서 구매하였고 formic acid는 Sigma Aldrich (St. Louis, MO, USA) 사의 제품을 사용하였다. 추출에 사용한 용매 중 dichloromethane (DCM), ethanol (EtOH), methanol (MeOH)은 J.T. Baker (Phillipsburg, NJ, USA) 사에서(MeOH만 MS grade) diethyl ether (DEE)는 삼천에서 LC grade 제품으로 구매하였다. In-house library 구축을 위한 식물 대사체 표준품은 Sigma Aldrich (St. Louis, MO, USA) 사의 PHYTOMLS (phytochemical metabolite library of standards)를 사용하였다.
In-house library 표준용액 제조 - PHYTOMLS 표준품들을 80% MeOH에 10 ppm 농도로 용해시킨 후, 20개씩 혼합하여 최종 농도가 0.5 ppm인 표준용액을 만들었다.9) 이 때 이성질체 및 m/z가 동일한 물질은 함께 혼합하지 않았으며 소스 내 단편화(in source fragmentation)가 발생하지 않도록 하였다.
분석시료 추출 및 준비 – 추출용매에 따른 추출효율을 비교하고자 12종 식물(갓, 곰취, 근대, 모시풀, 민들레, 바디나물, 방아풀, 병풍쌈, 블루베리, 시금치, 어수리, 헛개나무) 100 mg에 DCM, DEE, 70% EtOH, MeOH을 각각 1 mL를 가하고 상온에서 1시간 동안 초음파 보조 추출을 실시하였다. 추출물은 원심분리(10,000 g, 10 분) 하고 상층액을 0.2 μm syringe filter로 여과하여 분석에 사용하였다. 추가적인 식물 대사체 프로파일링을 위해 18종 식물(개똥쑥, 겨자, 고사리, 곤드레, 더덕, 돌나물, 뽀리뱅이, 산마늘, 셀러리, 쑥갓, 삼채, 양상추, 연, 유채나물, 참나물, 케일, 콜라비, 화살나무)을 70% EtOH과 MeOH을 사용해 동일한 방법으로 추출하였다.
LC-MS 기기 분석 조건 − 본 실험에서 in-house library 구축 및 식물 대사체 프로파일링에 동일한 기기 조건을 적용하였다. LC 분석에서 분리용 컬럼은 Acquity bridged ethyl hybrid C18 (1.7 μm, 2.1 mm × 100 mm)을 사용하였고 이동상은 0.1% formic acid를 함유한 water (A)와 acetonitrile (B)을 사용하였다. 15분 동안 gradient 분석을 실시하였는데, 초기 0.1 분 동안 0.3 mL/min의 유속으로 0.5% B를 흘려주었고 이후 10 분까지 유속을 유지한 상태에서 80% B를 유지하였다. 12 분까지 99.5% B로 이동상 B의 비율을 높여주었는데 이 때 유속은 10.1분까지 0.3 mL/min, 이후 10.1 분부터 12 분까지 0.4 mL/min으로 하였다. 이후 0.5% B로 다시 낮추어 15 분까지 유지하였는데 유속은 14.5 분에 0.3 mL/min으로 감소시켰다. Column oven temperature는 40 ℃로 구성하였고 시료는 2 μL를 주입하였다.
질량분석기(mass spectrometer, MS)로 6530 QTOF LC/MS (Agilent Technologies, Santa Clara, CA, USA)를 사용하였고, 이온화를 위해 electrospray ionization (ESI) mode를 적용하였다. 데이터 의존적 분석(Data dependent analysis, DDA)을 실시하였고 positive mode와 negative mode에서 MS1과 MS2의 m/z 범위는 각각 60-1,000, 0-1,000으로, collision energy는 10 eV, 30 eV, 50 eV로, MS resolution은 4 GHz로 설정하였다.
대사체 식별 및 데이터 처리 - 데이터 분석에는 MS-data independent analysis (DIAL) 소프트웨어를 사용하였다. In-house library는 각 표준품의 precursor m/z와 일치하는 peak을 통해 해당 물질의 retention time (RT) 및 MS2 fragmentation 정보(MS/MS)를 얻어 구축하였다. 식물 대사체 프로파일링은 in-house library와 MS-DIAL MSP spectral database를 통해 공개되어 있는 public library (RIKEN PlaSMA bio-MS/MS from plant tissues) 를 기반으로 실시하였다.10) 모든 대사체는 m/z, RT, MS/MS 정보의 일치 여부에 따라 식별하였으며 해당 peak의 signal to noise ratio (S/N ratio)가 3 이상인 경우 검출 가능한 것으로 판단하였다.11)
앞서 언급한 m/z와 RT에 대한 일치 여부는 각각의 similarity score가 900 이상인 경우 일치하다고 판단하여 해당 대사체들을 식별하였고, 이는 경험적으로 잘못 식별된 위양성(false positive) 결과를 모두 배제할 수 있는 기준이다. MS/MS 일치 여부의 경우 Rev. dot score 값이 750 이상인 것들만 선별하였고, 이는 핵심 조각이온(fragment ion)의 일치를 보장하는 값이다..
결과 및 고찰
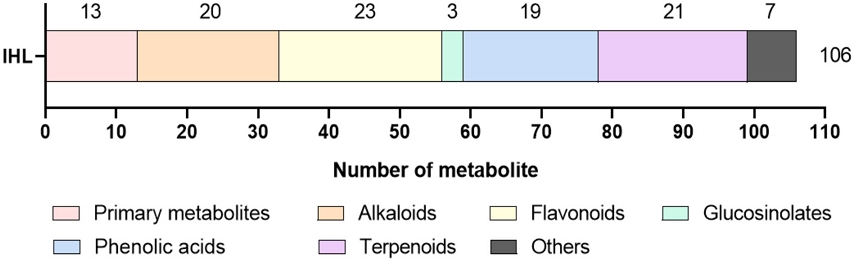
In-house library 구축 - Positive와 negative ESI mode에서 10 eV, 30 eV, 50 eV의 세 가지 collision energy를 적용해 PHYTOMLS 표준품들을 분석하였다. 각각의 표준품들을 식별하기 위해 두 가지 polarity mode에서 생성되는 precursor ion의 m/z를 조사해 비교하였고, 총 106개 표준품에 대해 RT와 MS/MS 데이터를 확보하여 in-house library로 제작하였다(Table 2).
식물 대사체를 기능과 생리적 역할에 따라 1차 대사체(primary metabolites)와 2차 대사체(secondary metabolites)로 구분하고 구조 및 생합성 경로를 기반으로 더욱 세분화하는 분류법을 in-house library에 포함된 물질들에 적용한 결과, 각 분류별로 해당하는 대사체들을 고르게(1차 대사체 13개, alkaloids 20개, flavonoids 23개, glucosinolates 3개, phenolic acids 19개, terpenoids 21개, 기타 7개) 포함하고 있음을 확인하였다(Fig. 1).
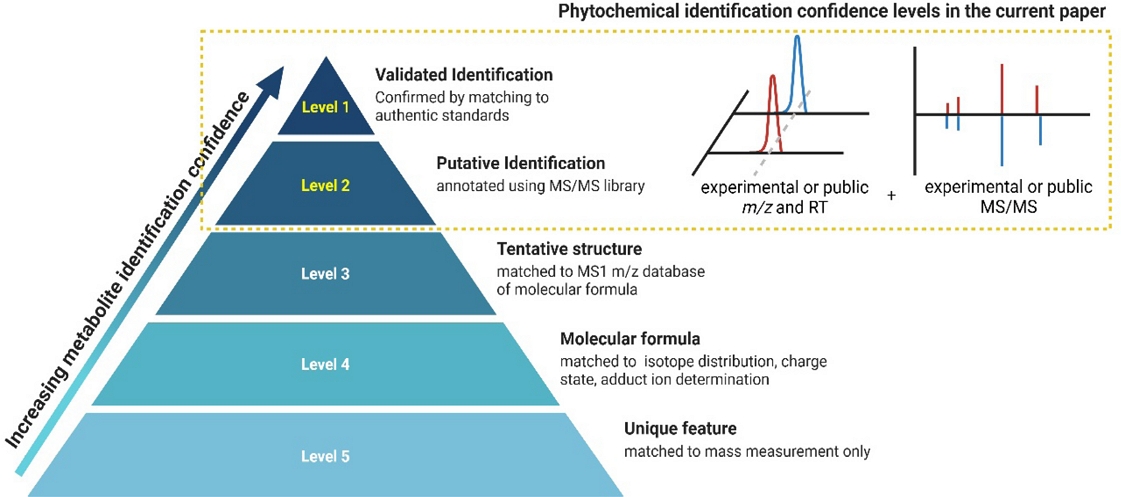
본 실험에서 모든 식물체에 대한 대사체 프로파일링은 in-house library와 public library를 기반으로 진행하였다. In-house library를 이용한 대사체 프로파일링은 m/z, experimental RT, experimental MS/MS와의 매칭 정도를 기반으로 실시되어 MSI level 1에 해당하는 매우 높은 신뢰도(highest)가 보장된다. Public library를 활용한 경우에는 m/z와 public library database의 RT 및 MS/MS와의 매칭 정도에 기반하며, 이를 통해서도 MSI level 2의 높은 신뢰도(high)를 바탕으로 대사체 식별이 이루어지기 때문에 본 실험에서 확인한 모든 대사체는 그 근거가 명확하다고 할 수 있다(Fig. 2).12)
추출용매에 따른 추출 효율 비교 - 식물 대사체의 글로벌 프로파일링을 목적으로 추출에 사용할 용매를 선택하기 위해 식물 대사체 추출에 흔히 사용되는 DCM, DEE, 70% EtOH, MeOH의 추출효율을 비교하였다. 12종 식물(갓, 곰취, 근대, 모시풀, 민들레, 바디나물, 방아풀, 병풍쌈, 블루베리, 시금치, 어수리, 헛개나무)을 DCM, DEE, 70% EtOH, MeOH로 각각 추출한 후 검출되는 대사체를 비교한 결과, 모든 종의 식물에서 70% EtOH 및 MeOH로 추출하였을 때 DCM 및 DEE로 추출하였을 때에 비해 더 많은 수의 대사체가 검출됨을 확인하였다. 평균적으로 DCM 추출에서 103개, DEE 추출에서 100개, 70% EtOH 추출에서 125개, MeOH 추출에서 124개의 대사체가 확인되었다. 12종 식물 별로 네 가지 추출용매를 사용한 추출에서 검출된 대사체의 수는(Fig. 3a)와 같다.
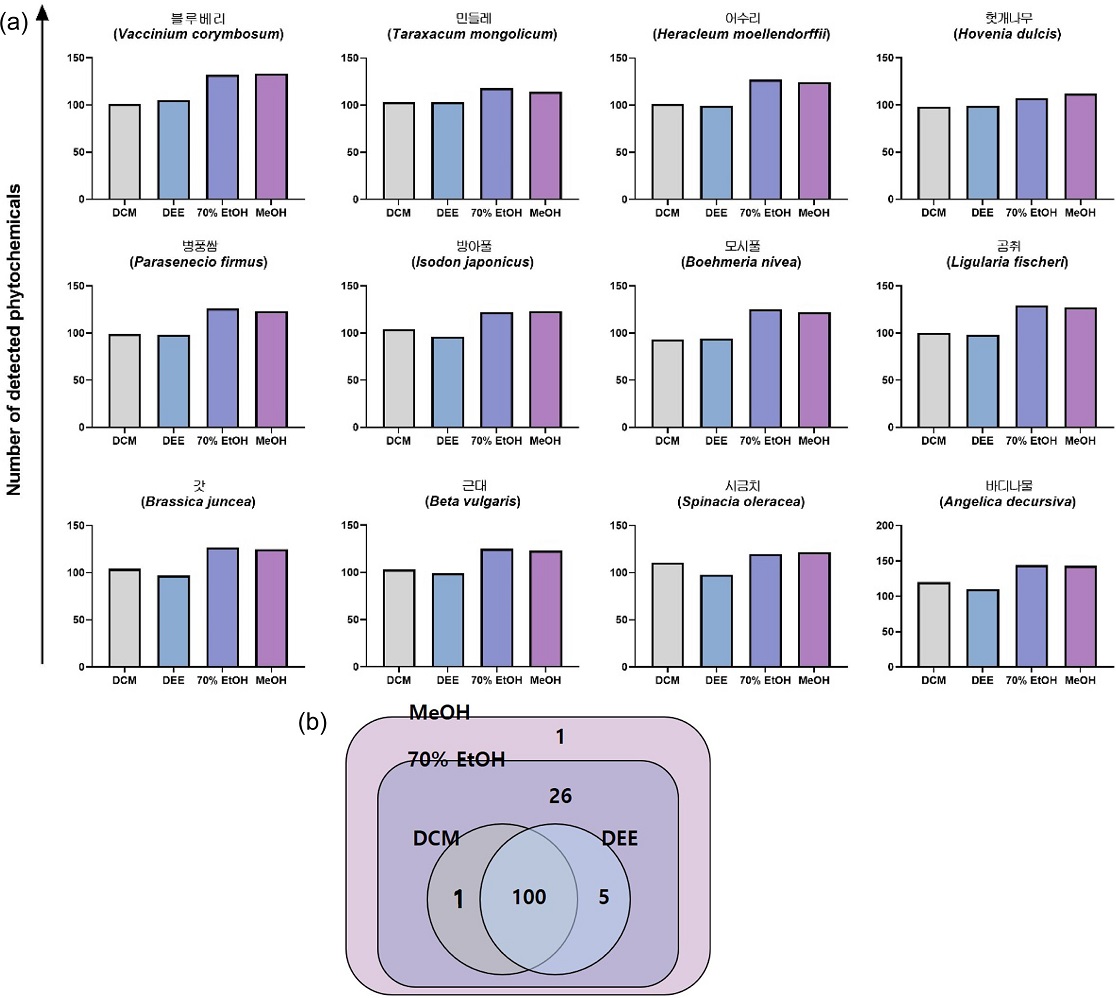
(a) Number of metabolites extracted from 12 plants with DCM, DEE, 70% EtOH, MeOH; (b) Inclusion relationships among metabolites extracted by each solvent from blueberry
이어서 각 추출용매에서 특이적으로 추출 가능한 대사체의 존재 여부를 확인하였다. 12종 식물 모두에서 DCM과 DEE를 사용해 추출되는 모든 대사체가 70% EtOH 및 MeOH 추출에서도 동일하게 추출되었으나, 70% EtOH과 MeOH으로 추출 가능한 대사체 중에서는 DCM과 DEE 추출에서 검출할 수 없는 것들이 존재했다. 한 예로, 블루베리를 DCM과 DEE로 추출했을 때, 100개의 공통 대사체와 각각에서 1개, 5개의 대사체가 추가적으로 추출되었다. 또한 70% EtOH 및 MeOH로 추출했을 때 DCM 및 DEE로 추출한 106개의 모든 대사체에 더불어 27개의 추가적인 대사체까지 검출할 수 있었다(Fig. 3b). 즉, 70% EtOH과 MeOH 특이적으로 추출 가능한 식물 대사체들이 있음을 확인하였고 이들 중에는 직접적인 생리 활성을 지닌 기능성 대사체도 포함되어 있었다. 대표적으로 항산화/항염증/신경보호 기능을 하는 kynurenic acid와 그 합성 전구체인 tryptophan, 강력한 항산화 기능과 더불어 항염증, 항암 효과까지 지닌 quercetin, 지질개선 및 간보호 등의 역할을 수행하는 cynarin, 그리고 당뇨 및 고지혈증 등의 질환 치료에 효과가 있는 rutin 등이 이에 해당한다. 13-16)
결과적으로 본 실험에서 확인한 네 종류의 추출용매 중 70% EtOH과 MeOH이 가장 많은 수의 대사체를 추출할 수 있었으며, 이는 DCM과 DEE로 추출 가능한 모든 대사체에 추가적으로 추출되는 대사체들을 포함하는 것을 확인하였다. 이에 따라 70% EtOH과 MeOH의 추출효율이 상대적으로 우수함을 입증하였다.
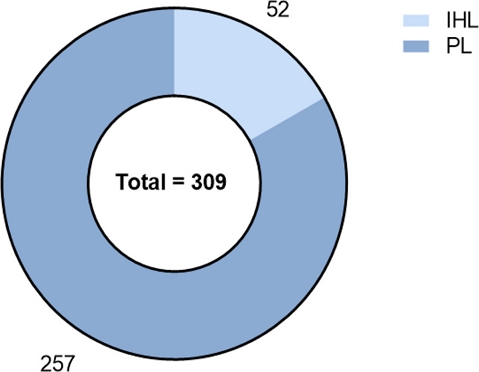
국내 약용 및 기능성 식물 30종 대사체 글로벌 프로파일링 - 12종 식물에 이어 추가적으로 18종 식물을 70% EtOH 및 MeOH로 추출하여 대사체 글로벌 프로파일링을 실시하였다. 전체 30종 식물에서 검출한 대사체는 총 309개였고 이들 중 52개(positive mode: 36개, negative mode: 16개)는 in-house library를, 257개(positive mode: 146개, negative mode: 111개)는 public library를 기반으로 식별하였다(Fig. 4). 평균적으로 식물 마다 139개의 대사체가 확인되었고 각각의 식물에서 검출된 대사체의 수와 종류는(Table 3, Fig. 5)와 같다. 모든 식물에서 공통적으로 검출된 대사체를 확인한 결과 그 개수는 총 28개였고 핵산 구성성분(adenosine, guanosine, uridine), 필수 아미노산(leucine, isoleucine), 시트르산 회로 핵심 대사체(succinic acid) 등 식물 생장과 기본적 생리 기능 유지에 필수적인 1차 대사산물들이 이에 포함되어 있음을 확인하였다. 뿐만 아니라, 약용 및 기능성 식물들을 대상으로 분석을 진행한 만큼 생리 활성을 지닌 식물대사체로 알려진 대표적인 물질들도 공통적으로 검출되었다. 대표적으로 강력한 항산화능을 지닌 catechin, apigenin-7-O-glucoside, dicaffeoyl quinic acid, kaempferol, phloridzin, quercetin-3-O-glucoside, trans-ferulic acid가 모든 식물에서 검출되었다.17-23)

Whole list of detected metabolites (28 common metabolites detected in all plants are indicated in bold)
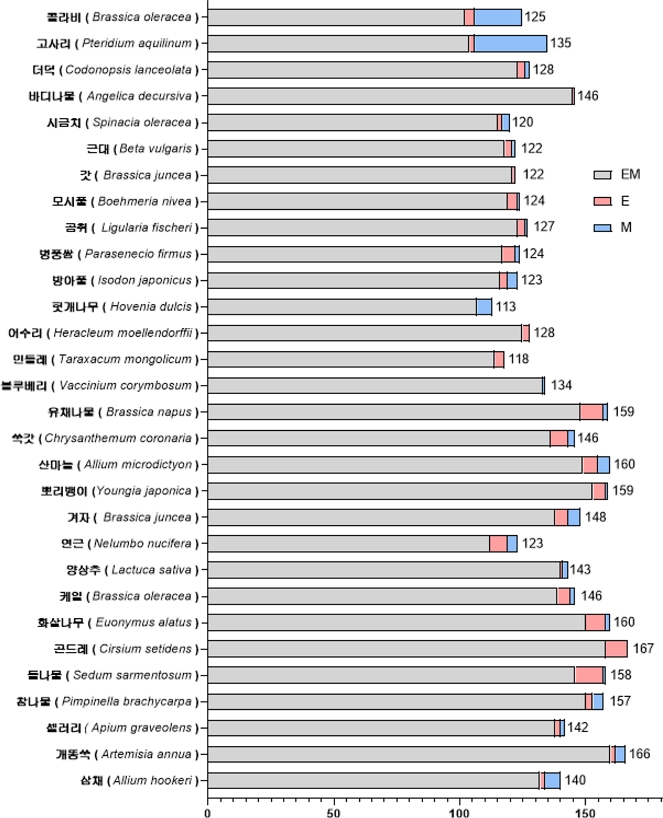
Number of identified metabolites in 30 plants. EM: Identified both in 70% EtOH and MeOH extracts. E: Identified only in 70% EtOH extract. M: Identified only in MeOH extract.
이러한 공통 대사체 외에도 각 식물에서 100개 내외의 추가적인 대사체들이 특징적으로 검출되었다. 서로 다른 구조적, 기능적 분류에 속하는 대사체들을 고르게 검출할 수 있었는데 alkaloids (anabasamine, harmine, yohimbic acid), flavonoids (apigenin, baicalein, catechin, eriocitrin, quercetin, rutin), phenolic acids (caffeic acid, coumaric acid, sinapic acid), terpenoids (ginkgolide A, ginkgolide C, atractylenolide III), vitamin (niacinamide, pantothenic acid)와 같은 대사체들을 비롯해 fatty acids (FA), lysophosphatidylethanolamine (LPE), lysophosphatidylcholine (LPC)을 포함한 지질체까지 다양하게 확인되었다.
결 론
약용 및 기능성 식물의 의약적 효능은 해당 식물 내 존재하는 생리 활성 대사체로부터 기인한다. 따라서 특정 식물의 의약적 효능을 예측하고 천연물의약품으로서의 활용 가치를 판단하는 데에 있어 해당 식물 내 대사체 풀 구성을 이해하는 것은 매우 중요하다. 그러나 많은 연구가 특정 대사체에 대한 정성 및 정량 분석에 집중하고 있어 전체적인 대사체 풀을 파악하는 연구가 부족한 상황이다. 본 연구에서는 국내에서 사용되는 약용 및 기능성 식물 30종을 선정하고 액체크로마토그래피-질량분석법을 기반으로 대사체 글로벌 프로파일링을 진행하였다. 대사체 식별에 있어 MSI level 1에 해당하는 높은 신뢰도를 확보하기 위해 in-house library를 직접 제작하였고 이를 기반으로 분석을 실시하였다. 총 106개의 표준품을 분석해 각각의 m/z, RT, MS/MS 정보를 확보하였고 이를 기반으로 library가 구축되었다. 또한 가능한 많은 수의 대사체를 프로파일링 하기 위해 DCM, DEE, 70% EtOH, MeOH의 추출효율을 비교하였고 70% EtOH과 MeOH을 추출용매로 사용하는 것이 가장 적합함을 확인하였다. 70% EtOH과 MeOH에서 추출되는 대사체의 수가 가장 많았고 DCM과 DEE로 추출 가능한 모든 대사체는 70% EtOH과 MeOH로도 추출할 수 있었다. 70% EtOH과 MeOH 추출에서는 각각 특이적으로 확인되는 대사체들이 있었기에 두 가지 용매를 모두 사용하는 것이 가장 많은 수의 대사체를 검출할 수 있는 방법이었다. 해당 결과를 바탕으로 최종적으로 총 30개의 약용 및 기능성 식물 내 대사체 글로벌 프로파일링을 실시하였고 309개의 대사체 풀을 확보하였다. In-house library 기반의 신뢰도 높은 식물 대사체 글로벌 프로파일링을 통해 의약적 생리 활성 대사체를 함유한 식물을 스크리닝 하고 천연물의약품 및 기능성 식품의 원료로서의 활용 가능성을 확인할 수 있을 것으로 사료된다.
Acknowledgments
This research was supported by the Rural Development Administration of Korea (PJ017031)
References
- Emeka, P., Emeka and Badger-Emeka, L. (2016) Recent progress in medicinal plants, 471-484. Studium press, UK.
-
Wink, M. (2015) Modes of action of herbal medicines and plant secondary metabolites. Medicines (Basel) 2: 251-286.
[https://doi.org/10.3390/medicines2030251]

-
Zhao, Y., Liu, G., Yang, F., Liang, Y., Gao, Q., Xiang, C., Li, X., Yang, R., Zhang, G., Jiang, H., Yu, L. and Yang, S. (2023) Multilayered regulation of secondary metabolism in medicinal plants. Molecular Horticulture 3: 11.
[https://doi.org/10.1186/s43897-023-00059-y]

-
Wang, S. C., Alseekh, S., Fernie, A. R. and Luo, J. (2019) The structure and function of major plant metabolite modifications. Molecular Plant 12: 899-919.
[https://doi.org/10.1016/j.molp.2019.06.001]

-
Yeshi, K., Crayn, D., Ritmejeryte, E. and Wangchuk, P. (2022) Plant secondary metabolites produced in response to abiotic stresses has potential application in pharmaceutical product development. Molecules 27: 313.
[https://doi.org/10.3390/molecules27010313]

- Muhammad Zeeshan, B., Hammad, I. and Waqas Khan, K. (2022) Secondary metabolites - trends and reviews, 201-229. IntechOpen, Croatia.
-
Manickam, S., Rajagopalan, V. R., Kambale, R., Rajasekaran, R., Kanagarajan, S. and Muthurajan, R. (2023) Plant metabolomics: Current initiatives and future prospects. Curr. Issues Mol. Biol. 45: 8894-8906.
[https://doi.org/10.3390/cimb45110558]

-
Patel, M. K., Pandey, S., Kumar, M., Haque, M. I., Pal, S. and Yadav, N. S. (2021) Plants metabolome study: Emerging tools and techniques. Plants (Basel) 10: 2409.
[https://doi.org/10.3390/plants10112409]

-
Tsugawa, H., Nakabayashi, R., Mori, T., Yamada, Y., Takahashi, M., Rai, A., Sugiyama, R., Yamamoto, H., Nakaya, T., Yamazaki, M., Kooke, R., Bac-Molenaar, J. A., Oztolan-Erol, N., Keurentjes, J. J. B., Arita, M. and Saito, K. (2019) Publisher correction: A cheminformatics approach to characterize metabolomes in stable-isotope-labeled organisms. Nat. Methods 16: 446.
[https://doi.org/10.1038/s41592-019-0423-x]

-
Tsugawa, H., Nakabayashi, R., Mori, T., Yamada, Y., Takahashi, M., Rai, A., Sugiyama, R., Yamamoto, H., Nakaya, T., Yamazaki, M., Kooke, R., Bac-Molenaar, J. A., Oztolan-Erol, N., Keurentjes, J. J. B., Arita, M. and Saito, K. (2019) A cheminformatics approach to characterize metabolomes in stable-isotope-labeled organisms. Nat. Methods 16: 295-298.
[https://doi.org/10.1038/s41592-019-0358-2]

- Boqué, R. and Heyden, Y. (2009) The limit of detection. LC-GC Eur. 22: 82-85.
-
Reisdorph, N. A., Walmsley, S. and Reisdorph, R. (2020) A perspective and framework for developing sample type specific databases for lc/ms-based clinical metabolomics. Metabolites 10: 8.
[https://doi.org/10.3390/metabo10010008]

-
Wróbel-Kwiatkowska, M., Turski, W., Silska, G., Rakicka-Pustulka, M., Dyminska, L. and Rymowicz, W. (2024) Determination of bioactive compound kynurenic acid in linum usitatissimum l. Molecules 29: 1702.
[https://doi.org/10.3390/molecules29081702]

-
Aghababaei, F. and Hadidi, M. (2023) Recent advances in potential health benefits of quercetin. Pharmaceuticals 16: 1020.
[https://doi.org/10.3390/ph16071020]

- Gezer, C. (2017) Potential health effects of the popular compound of artichoke: Cynarin. Progress in Nutrition 19: 5-9.
-
Negahdari, R., Bohlouli, S., Sharifi, S., Dizaj, S. M., Saadat, Y. R., Khezri, K., Jafari, S., Ahmadian, E., Jahandizi, N. G. and Raeesi, S. (2021) Therapeutic benefits of rutin and its nanoformulations. Phytotherapy Research 35: 1719-1738.
[https://doi.org/10.1002/ptr.6904]

-
Razavi, S. M., Zahri, S., Zarrini, G., Nazemiyeh, H. and Mohammadi, S. (2009) Biological activity of quercetin-3-o-glucoside, a known plant flavonoid. Russian Journal of Bioorganic Chemistry 35: 376-378.
[https://doi.org/10.1134/S1068162009030133]

-
Bernatoniene, J. and Kopustinskiene, D. M. (2018) The role of catechins in cellular responses to oxidative stress. Molecules 23: 965.
[https://doi.org/10.3390/molecules23040965]

-
Wang, W., Yue, R. F., Jin, Z., He, L. M., Shen, R., Du, D. and Tang, Y. Z. (2020) Efficiency comparison of apigenin-7-o-glucoside and trolox in antioxidative stress and anti-inflammatory properties. Journal of Pharmacy and Pharmacology 72: 1645-1656.
[https://doi.org/10.1111/jphp.13347]

-
Danino, O., Gottlieb, H. E., Grossman, S. and Bergman, M. (2009) Antioxidant activity of 1,3-dicaffeoylquinic acid isolated from. Food Research International 42: 1273-1280.
[https://doi.org/10.1016/j.foodres.2009.03.023]

-
Sharma, N., Biswas, S., Al-Dayan, N., Alhegaili, A. S. and Sarwat, M. (2021) Antioxidant role of kaempferol in prevention of hepatocellular carcinoma. Antioxidants 10: 1419.
[https://doi.org/10.3390/antiox10091419]

-
Park, S. and Park, S. K. (2022) Anti-oxidant and anti-aging effects of phlorizin are mediated by daf-16-induced stress response and autophagy in. Antioxidants 11: 1996.
[https://doi.org/10.3390/antiox11101996]

-
Srinivasan, M., Sudheer, A. R. and Menon, V. P. (2007) Ferulic acid: Therapeutic potential through its antioxidant property. Journal of Clinical Biochemistry and Nutrition 40: 92-100.
[https://doi.org/10.3164/jcbn.40.92]