오수유와 진피 복합물이 급성 역류성 식도염 개선에 미치는 항산화 효과
Abstract
This study aimed to evaluate the effects of a mixture of Evodiae Fructus and three anti-inflammatory herbal medicines on esophageal damage in a rat model of acute reflux esophagitis (ARE). Rats were divided into six groups as follows: Normal, normal group; ARE, acute reflux esophagitis group; EF (water extract), Evodiae Fructus; CRE (EtOH extract), Cnidii Rhizoma + Evodiae Fructus; GRE (water extract), Ginseng Radix + Evodiae Fructus; CPE (water extract), Citri Unshius Pericarpium + Evodiae Fructus. Each group was administered a dose of 200 mg/kg. 60 min after administration, ARE was induced in all groups except the Normal group. Blood and esophageal tissue were collected 90 min after ARE induction. Subsequently, oxidative stress in the blood was measured, and the levels of inflammatory, antioxidant, and tight junction (TJ)-related proteins in esophageal tissue were analyzed by Western blot. The results indicated that the expression levels of these proteins were significantly lower in the CRE, GRE, and CPE administration groups compared to the ARE group. Additionally, the experiments revealed that the combinations of the three extracts increased the expression of claudin-4 and occludin, as well as antioxidant activity, with a particularly notable increase in tight junction (TJ) proteins in the CPE group.
Keywords:
Evodiae Fructus, Acute reflux esophagitis, Reactive oxygen species, Anti-oxidant역류성 식도염(Reflux esophagitis)의 주요 원인으로는 위산의 역류와 위 내용물이 과도하게 노출되는 것으로, 내용물이 입으로 역류하거나 가슴 통증 등의 증상이 나타날 수 있다.1) 이는 위와 식도의 일시적인 하부식도괄약근(lower esophageal sphincter)의 이완 및 기능 결함이 식도 점막에 손상을 일으키는 것으로 알려져 있으며, 이로 인해 tumor necrosis factor-α (TNF-a)의 분비가 자극을 받아 조직 내 만성 염증과 산화 스트레스가 증가한다. 이러한 변화는 바렛 식도로 이어질 수 있으며, 이후 점막의 조직 변화가 식도 선암으로 발전할 수 있다.2,3)
최근 연구에 따르면, 산화 스트레스가 주요 원인으로 작용하여 수소 이온이 점막에 축적되고, 이로 인해 염증성 사이토카인의 분비가 증가하며 식도 점막이 손상된다고 알려져 있다.4) 결과적으로, 이러한 점막 손상은 염증 반응을 더욱 악화시키며, 점막의 재생 과정이 방해 받게 된다. 정상적인 식도 조직에서는 점액이 분비되어 식도 상피세포를 보호하고 외부 자극으로부터의 손상을 줄이며, 음식물의 이동을 원활하게 한다. 그러나 염증이 지속되면 점액 분비가 감소하여 식도의 방어 기능이 약화되고, 이로 인해 점막 손상이 더욱 악화될 수 있다.5) 역류성 식도염을 앓고 있는 환자들은 위산과 소화 효소 등 외부 자극에 지속적으로 노출되기 때문에, 이러한 상황에서 점액 분비가 방어 기전의 일환으로 촉진된다.6) 현재 사용되고 있는 점막 보호제는 sucralfate등이 있으며 위산 등으로부터 점막을 보호하여 증상을 호전 시키나 다른 약물과 함께 복용 시 약물의 흡수를 저해 할 수 있다.7) 따라서 점액 분비를 더욱 효과적으로 촉진할 수 있는 기전의 규명이 필요하며, 안전한 한의학적 치료에 대한 방향 제시가 중요한 시점이다. 이를 통해 역류성 식도염 치료의 새로운 대안을 제시할 수 있을 것이다.
본 실험에 사용된 오수유(Evodiae Fructus)는 운향과(Rutaceae)에 오수유(Evodia officinalis Dode)의 성숙한 열매를 건조한 것으로, 주요 생리활성 화합물은 alkalois, limonoids, volatile, oils, carboxylic acids 및 flavonoids이며, 항염 효과를 가지는 dehydroevodiamine, evodiamine, rutaecarpine 등의 성분이 함유되어 있다.8) 이 성분들은 항염증, 항산화 및 진통 효과등 염증 관련 질환의 치료에 도움이 될 수 있다고 알려져 있다.9) 최근까지 이어지는 연구를 통해 吳茱萸가 염증에 효과를 나타냈으며, 역류성 식도염에서 식도 점막 손상을 보호하는 것으로 확인되었다.10, 11) 본 연구는 이전 실험에서 역류성 식도염 동물 모델을 통하여 항균 및 항염증 효과가 있다고 알려진 오수유와 식도 점막세포에서 보호 효과를 보인 천궁(Cnidii Rhizoma), 인삼(Ginseng Radix), 진피(Citri Unshius Pericarpium)를 특정 배합비율로 혼합한 추출물의 식도 점막 보호 효과와 항염증 효과를 비교하고자 하였다. 이들 중 천궁, 인삼, 진피는 식도 점막세포에서 MUC5AC의 분비를 촉진하는 후보 물질로 우수한 효과를 보인 바 있으며,12) 본 연구에서는 위 3종의 추출물과 오수유를 배합하여 항염증 효과와 항산화 활성을 비교 분석하였다. 본 연구 결과, 오수유와 진피 복합물이 가장 우수한 효과를 보였으며, 오수유 단독에 비해 항산화 효과와 tight junction 강화 효과가 더욱 두드러지는 것으로 확인되었다. 이를 바탕으로 복합물이 급성 역류성 식도염 개선에 효과적일 것으로 판단된다.
재료 및 방법
시약 – Folin-Ciocalteu’s phenol reagent, gallic acid, quercetin, 2-Diphenyl-1-picrylhydeazyl (DPPH), 2,2’-azino-bis (3-ehylbenzothiazoline-6-sulphonic acid (ABTS), potassium phosphate monobasic, potassium phosphate dibasic, 1,1,3,3-tetramethoxypropane, 2-thiobarbituric acid, 2’,7’-dichlorofluorescein diacetate (DCFDA), sodium phosphate monobasic, sodium phosphate dibasic, potassium chloride (KCl), glycerol은 Sigma-Aldrich Co. (St. Louis, MO, USA) 에서 구입하였다. Sodium carbonate와 potassium acetate는 DAEJUNG chemicals&metals (Gyeonggi, Korea)에서 구입하여 사용하였다. Aluminum chloride, L-ascorbic acid, bicinchoninic acid (BCA) Protein assay kit는 Thermo Fisher Scientific (Waltham, MA, USA)에서 구입하였다. 1차 항체인 histone, β-actin, nuclear factor-kappa B p65 (NF-κBp65), cyclooxygenase-2 (COX-2), heme Oxygenase-1 (HO-1), catalase, glutathione peroxidase-1/2 (GPx-1/2), claudin-4, occludin은 Santa Cruz Biotechnology (Dallas, TX, USA)에서 구입하였으며, inducible nitric oxide synthase (iNOS)는 Cell Signaling Technology, Inc. (Beverly, MA, USA)에서 구입하였다. 2차 항체는 GeneTex, Inc. (Irvine, CA, USA)에서 구입하여 사용하였다. Protease inhibitor mixture는 Wako Pure Chemical Industries, Ltd. (Osaka, Japan))에서 구입하였으며, nitrocellulose membranes는 Amersham GE Healthcare (Little Chalfont, Bucks, UK)에서 구입하였다. ECL Western Blotting Detection Reagents는 GE Healthcare로부터 구입하여 사용하였다.
시료추출 – 본 실험에 사용된 오수유, 천궁, 인삼 및 진피는 옹기 한약국(Daegu, Korea)에서 구입하여 사용하였으며, 추출방법은 다음과 같다. 오수유, 인삼 및 진피 한약재는 100 g에 증류수 1,000 mL를 첨가한 후, 열탕 추출기(Daewoong Bio, Seoul, Korea)를 사용하여 2시간 동안 추출하였다. 또한 천궁 한약재는 100 g에 70% EtOH에 24시간 냉침하여 추출하여 농축하였다. 얻어진 열수 추출물들은 여과 후 회전 감압 추출장치(Buchi Labortechnik AG, Flawil, Switzerland)를 이용하여 농축하였으며, 동결건조기(Ilshin, Seoul, Korea)로 완전히 건조해 powder 형태로 만들었으며, 오수유(吳茱萸, Evodiae Fructus), 천궁(川芎, Cnidii Rhizoma), 인삼(人參, Ginseng Radix), 진피(陳皮 Citri Unshius Pericarpium)는 각각 EF, CR, GR, CP로 약어를 표기하여 실험에 사용하였다(yield; 18.0%, EF; 23.5%, CR; 12.7%, GR; 31.3%, CP).
Total polyphenol 및 total flavonoid 함량 측정 – 각 추출물(CR, GR, CP)과 EF 배합비(4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4) 별로 total polyphenol (TP) 및 total flavonoid (TF) 함량을 측정하였다.13-14) TP 측정을 위해 시료 100 μL에 10% Folin-Ciocalteu’s phenol reagent 500 μL를 첨가하고, 7.5% sodium carbonate 400 μL를 혼합하여 실온에서 30분간 암소 반응하였다. 그리고 microplate reader (Infinite M200; Tecan Group Ltd., Männedorf, Switzerland)를 이용하여 765 nm에서 흡광도를 측정하였다. 표준 물질인 gallic acid로 추출물의 TP 함량을 산출하였다. 또한, TF 측정은 시료 100 μL에 10% aluminum chloride solution 20 μL, 1 M potassium acetate solution 20 μL 및 methanol 300 μL를 넣고 증류수 560 μL를 혼합하였다. 실온에서 30분간 반응시킨 후, 415 nm에서 흡광도를 측정하였다. 표준물질인 quercetin을 사용하였으며 TF의 함량을 산출하였다.
DPPH 및 ABTS 라디칼 소거 활성 측정 – DPPH 자유 라디칼 소거 활성 측정은 항산화 물질의 활성을 Blois법을 활용하여 측정하였다.15) 각 추출물과 EF의 배합비로 희석한 시료 100 μL와 60 μM DPPH 용액 100 μL를 혼합하여 30분간 암소 상태로 방치한 후, microplate reader를 이용하여 540 nm에서 흡광도를 측정하였다. ABTS 자유 라디칼 소거 활성 측정은 Re 등의 방법을 참고하여 측정하였다.16) 7.4 mM ABTS 용액과 2.4 mM potassium persulfate를 혼합하여 540 nm에서 흡광도 값이 0.70 ± 0.02가 되도록 ethanol로 희석하였다. 농도별로 희석한 시료 5 μL와 희석된 ABTS 용액 95 μL를 혼합하여 15분 동안 방치 후 415 nm에서 흡광도를 측정하였다. DPPH와 ABTS에 대한 라디칼 소거 활성은 inhibition % = [(Absorbance of Control − Absorbance of Sample)/Absorbance of Control] × 100 값으로 나타내었다.
실험 동물 – 7주령 Sprague-Dawley (SD) 수컷 쥐를 DBL (Eumseong, Korea)에서 구입하여 일주일 동안 실험실 환경에 적응시킨 후 실험에 사용하였다. 동물 사육실은 conventional system으로 온도 22 ± 2℃, 습도 50 ± 5%, 명암 주기(light: dark cycle)는 12시간 주기로 조절되며, 사료(NIH-41, Zeigler Bros, Inc., USA)와 물을 충분히 공급하였다. 본 실험은 대구한의대학교 동물 실험윤리 위원회(Institutional Animal Care and Use Committee)로부터 동물실험의 윤리적, 효율적인 관린 및 과학적 타당성에 대한 승인(승인번호: DHU2023-046)을 얻어 동물실험을 진행하였다.
급성 역류성 식도염 유발 및 동물 처치 – 실험군 총 6군으로 아무런 처치를 하지 않은 정상군(NOR군), 급성 역류성 식도염을 유발한 대조군(ARE군), EF 투여 후 급성 역류성 식도염을 유발한 EF군, CR:EF (1:4) 혼합물 투여 후 급성 역류성 식도염을 유발한 CRE군, GR:EF (1:4) 혼합물 투여 후 급성 역류성 식도염을 유발한 GRE군, CP:EF (1:4) 혼합물 투여 후 급성 역류성 식도염을 유발한 CPE군으로 각 그룹당 5마리씩 무작위로 분류하였으며, 모든 투여군에 해당 약물을 200 mg/kg 용량으로 투여하였다. 실험 전날까지 고형사료와 물을 충분히 공급하였으며, 실험을 진행하기 18시간 전부터 절식 하였다. 수술 당일 각 시료를 DW에 녹여 경구투여하고 1시간 후 isoflurane (Wellona Pharma, Indo)로 흡입마취 하였다. 복부를 2 ㎝ 정도 개복하여 위 조직의 위저부 및 날문부를 실크(2-0)실로 묶은 후 복막과 피부를 봉합하였으며, 5시간 후 희생하여 복대정맥에서 혈액을 채취하였고, 식도 조직을 적출하였다. 채취한 혈액은 4℃, 1,508 × g으로 10분간 원심분리하여 혈청을 분리하였으며, 실험에 사용하기 전까지 혈청과 식도 조직은 –80℃에서 보관하였다.
식도 점막 손상도 측정 – 적출한 식도 조직을 광학 디지털 카메라(DSCHX50V, Sony, Tokyo, Japan)를 이용하여 촬영하였다. 손상된 식도 점막 측정은 I-Solution lite (Innerview Co., Gyeonggido, Korea) 프로그램을 이용하여 손상 부위의 면적을 측정한 후, 식도 전체 면적과 비교하여 비율(%)로 산출하였다.
조직병리학적 분석 – 적출한 식도 조직을 10% formalin에 피부 조직을 3일 고정한 다음, hematoxylin & eosin (H&E) stain을 시행하였으며, 광학현미경을 이용하여 피부 조직의 특이 병변 유무 상태를 관찰하였다.
혈청 내 ROS 측정 – 혈청 내 reactive oxygen species (ROS)의 변화를 측정하고자 하였다. Black 96-well plate에 혈청 5 μL와 50 mM phosphate buffer 95 μL를 혼합하고, 1.25 mM 2',7'-dichlorofluorescein diacetate (DCFDA) 25 μL를 첨가하여 0분부터 매 5분씩 em 530 nm와 ex 485 nm으로 30분간 변화량을 형광값으로 측정하였다. 측정된 흡광도는 정상군 대비(fold of NOR)로 계산하였다.
혈청 내 염증성 사이토카인 측정 – 분리된 혈청 내 염증성 사이토카인을 측정하기 위하여 tumor necrosis factor-α (TNF-α)와 interleukin-1 beta (IL-1β)를 ELISA kit (Koma Biotech, Seoul, Korea)로 분석하였다. 표준물질과 혈청 각 100 μL를 well에 넣고 2시간 동안 실온에서 반응하였다. 이 후, 혈청과 표준물질을 제거하고 세척한 뒤, 각각의 검출 항체 100 μL 넣고 2시간 동안 실온에서 배양하였다. 그 후, wash buffer로 세척하고, streptavidin-horseradish peroxidase 100 μL 넣고 20분간 반응시켰다. 각 well에 3,3',5,5'-tetramethylbenzidine solution 100 μL 넣고 실온에서 배양한 다음, 적절한 발색이 나타나면 stop solution 100 μL를 첨가하여 450 nm에서 흡광도를 측정하였다.
Malondialdehyde (MDA) 측정 – 실험 동물의 혈액과 식도 조직에서 분리된 세포질에서 Mihara의 방법에 따라 malondialdehyde (MDA) 수치를 측정하였다.17) 1% H3PO4 75 μL와 0.67% thiobarbituric acid (TBA) 250 μL를 혼합한 후 95℃에서 45분간 반응시켰으며, 그 후 750 μL의 n-butanol 추가 후 원심분리하여 butanol을 분리시켰다. 분리된 상층액은 540 nm의 파장에서 OD값을 측정하였으며, 표준 물질 MDA 시약을 사용하여 표준검량선에 대입하여 혈액과 식도 조직 내 MDA 수치를 나타내었다.
Immunoblotting – 식도 조직의 세포질을 얻기 위해 10 mM KCl, 10 mM hydroxyethyl piperazine ethane sulfonicacid (HEPES; pH 7.4), 2mM MgCl2, 1mM dithiothreitol (DTT), 0.1mM phenylmethylsulfonyl fluoride (PMSF), 0.1 mM ethylenediaminetetraacetic acid (EDTA), protease inhibitor cocktail solution이 포함된 buffer A를 사용하였다. 조직을 tissue grinder (Biospec Product, Bartlesville, OK, USA)로 분쇄한 후, 30분간 정치하였다. 그 후, 10% NP-40을 첨가하여 13.572 × g, 4℃, 2분으로 원심분리하여 상층액을 분리하였다. 핵을 얻기 위해 10% NP-40이 포함된 buffer A에 세척한 후, 100 μL의 buffer C (50 mM HEPES, 50 mM KCl, 0.3 mM NaCl, 0.1 mM EDTA, 1 mM DTT, 0.1 mM PMSF, 10% glycerol)를 첨가하고 10분마다 vortex를 3번 하였다. 그 후, 13,572 × g, 4℃, 10분에서 원심 분리하여 핵을 포함하고 있는 상층액을 얻어 −80℃에서 냉동 보관하였다. 분리된 세포질과 핵에서 단백질 발현을 측정하고자, 10 μg의 단백질을 10–12% sodium dodecyl sulfate polyacrylamide gel을 이용하여 전기 연동 후, nitrocellulose membrane으로 transfer하였다. 1차 항체를 1:1,000 희석하여 4℃에서 overnight 시킨 다음, phosphate buffered saline with Tween 20 (PBS-T)로 10분마다 5회 세척하고, 2차 항체를 1:4,000 희석하여 상온에서 2시간 반응시킨 후, PBS-T로 10분마다 3회 세척하였다. 단백질 발현을 확인하기 위하여 membrane을 ECL에 노출시켜, Vilber Fusion Solo X (Vilber Lourmat, Marne La Vallee, France)에 감광시켜 각 membrane의 단백질 발현을 확인하였다. Evolution Capt Edge software (Vilber Lourmat) 프로그램으로 정량하였다.
통계분석 – 실험에 사용된 값들은 mean ± standard error mean (SEM)으로 표시하였으며, SPSS (Version 26.0, IBM, Armonk, NY, USA)를 사용하여 one-way analysis of variance (ANOVA) test를 사용한 후, least-significant differences (LSD) test로 사후검정을 실시하여 유의수준 p<0.05일 경우 유의성이 있다고 판단하였다.
결과 및 고찰
Total polyphenol 및 total flavonoid 함량 – 최근 식물 추출물들이 자유라디칼을 제거하여 ROS로 인한 산화스트레스로부터 생물학적 시스템을 보호하는 연구가 활발히 진행 되고 있다.18) 본 실험에서는 각 추출물(CR, GR, CP)과 EF 배합비(4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4)에 따른 항산화 활성을 평가하기 위해 TP 및 TF 함량을 측정한 결과, 각 추출물의 배합비중에서 1:4의 배합비가 뛰어난 항산화 활성을 나타냈다. TP의 함량은 CRE 37.48 ± 0.18 mg GAE/g, GRE 36.28 ± 0.64 mg GAE/g, CPE 38.83 ± 0.14 mg GAE/g로 확인되었으며, TF의 함량은 CRE 18.22 ± 0.44 mg QE/g, GRE 18.63 ± 0.05 mg QE/g, CPE 16.11 ± 0.15 mg QE/g로 확인되었다(Table I).
DPPH 및 ABTS 라디칼 소거 활성 측정 – DPPH 및 ABTS 라디칼 소거 활성은 식물 추출물 및 항산화제의 활성을 평가하는 데 널리 사용되는 방법으로, 항산화 물질과 반응 시 색 변화가 나타난다.19) 본 실험에서 DPPH 및 ABTS 라디칼 소거 활성을 측정한 결과, 표준물질인 L-ascorbic acid의 IC50 값은 각각 3.11 ± 0.25 μg/mL, 3.58 ± 0.90 μg/mL로 나타났다. 각 배합비 중 1:4 비율에서 가장 우수한 억제능을 나타났으며, 다음과 같은 값을 얻었다. DPPH는 CRE 92.27 ± 0.10, GRE 91.15 ± 0.42, CRE 91.27 ± 0.34로 나타났으며, ABTS는 CRE 81.32 ± 0.63, GRE 68.46 ± 1.10, CPE 80.37 ± 0.60로 나타났다. 전반적으로 CRE > CPE > GRE 순으로 항산화 활성이 확인되었다(Table II).
식도 점막 손상도 측정 – 식도 점막의 손상 정도를 육안으로 관찰한 결과, 아무런 처치를 하지 않은 정상군에서는 손상이나 궤양이 발견되지 않았으나, 급성 역류성 식도염을 유발한 ARE군에서는 식도 전체에서 병변이 확인되었다. 정상군(3.8 ± 0.3)에서는 손상 부위가 없었으며, ARE군은 손상 정도가 52.2 ± 1.7로 증가하였다. EF군(41.2 ± 6.4), CRE군(43.4 ± 2.1), GRE군(42.2 ± 2.7), CPE군(39.7 ± 4.3)에서는 역류성 식도염을 유발한 대조군에 비해 손상 정도가 유의미하게 감소한 것으로 나타났다(Fig. 1).
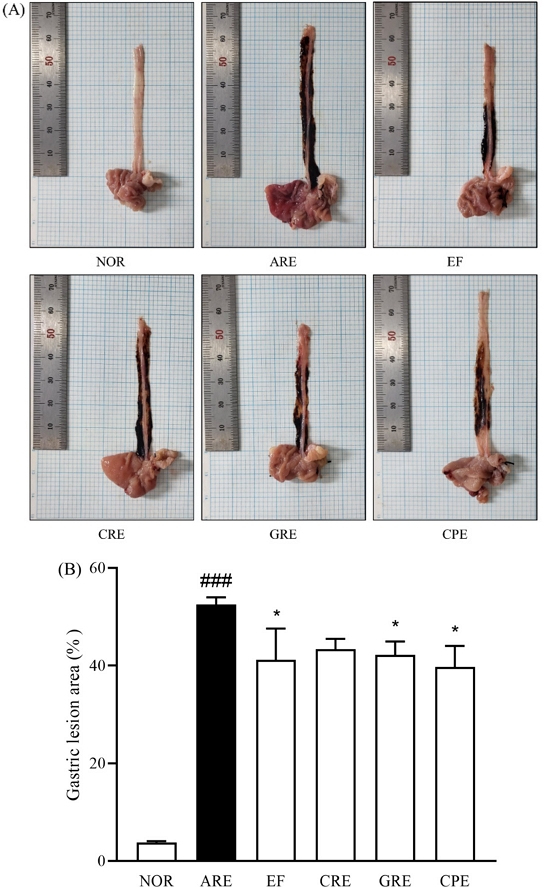
Surgical induction of reflux esophagitis. (A) Representative image of reflux esophagitis. (B) Esophageal ulcer ratio. NOR, normal group; ARE, acute reflux esophagitis group; EF, Evodia Fructus (200 mg/kg); CRE, Cnidii Rhizoma + Evodia Fructus (200 mg/kg) 1:4, GRE, Ginseng Radix + Evodia Fructus (200 mg/kg) 1:4; CRE, Citri Unshius Pericarpium + Evodia Fructus (200 mg/kg) 1:4. Data are expressed as means ± SEM, n=5. Significance: ###p < 0.001 vs. Normal group, *p < 0.05 vs. Control group.
조직 병리학적 검사 – 급성 역류성 식도염을 유발한 동물의 식도 조직을 육안으로 관찰한 결과, 정상군에서는 식도 점막에서의 조직학적 변화가 관찰되지 않았으며, ARE군에서는 전반적인 식도의 손상 및 식도 상피의 탈락, 점막하층의 혈전 및 부종을 관찰되었다. 반면, CRE군, GRE군, CPE군에서는 ARE군에 비해 식도 점막 병변이 감소하는 경향을 보였다(Fig. 2).
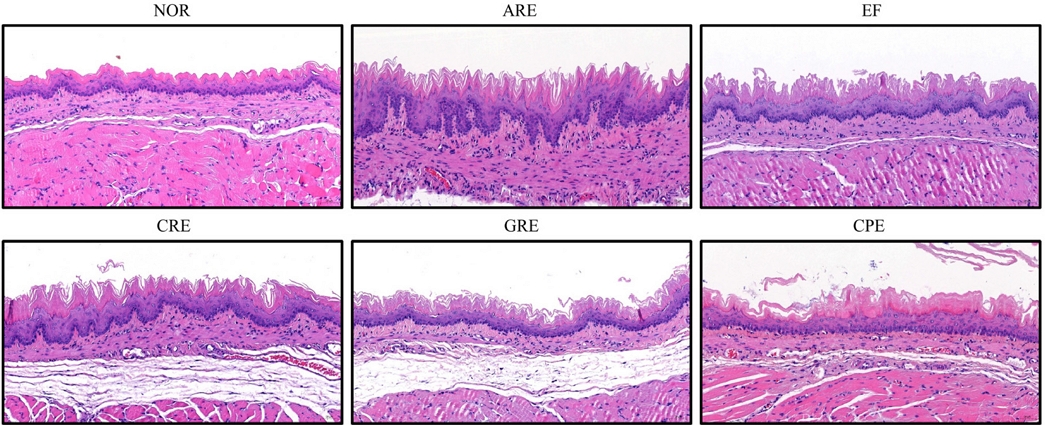
The effects of extract mixture on the histopathological changes epididymis esophageal tissues in reflux esophagitis. Esophagus tissues were stained with H&E (Original magnification ×200). Data are expressed as means ± SEM, n=5. NOR, normal group; ARE, acute reflux esophagitis group; EF, Evodia Fructus (200 mg/kg); CRE, Cnidii Rhizoma + Evodia Fructus (200 mg/kg) 1:4, GRE, Ginseng Radix + Evodia Fructus (200 mg/kg) 1:4; CRE, Citri Unshius Pericarpium + Evodia Fructus (200 mg/kg) 1:4.
혈청 내 Reactive oxygen species (ROS) 측정 결과 – 역류성 식도염의 주된 원인으로 알려진 ROS의 과도한 생성은 염증 매개체 및 사이토카인 생성을 유도하여 노화와 염증을 촉진 한다.20) 식도 자극에 의해 증가된 ROS가 DCF-DA와 반응하면 쉽게 세포 안으로 확산하여 세포 안의 esterase에 의해 형광을 잃은 DCFH로 가수 분해되어 녹색 형광을 띄게 된다. 본 실험에서는 동물의 혈액으로 측정하였으며, 그 결과 값을 정상군 대비 백분율(% of NOR)로 표시하였다. 정상군 100.0 ± 1.8과 비교하여 ARE군에서 ROS 수치가 122.6 ± 2.7로 증가한 반면, EF군은 101.5 ± 6.0 (p<0.01), CRE군은 109.6 ± 4.5 (p<0.01), GRE군은 103.0 ± 7.9 (p<0.01), CPE군은 100.0 ± 3.9 (p<0.01)으로 모두 유의미한 감소가 나타났다. 각 군을 비교한 결과, CPE군 > GRE군 > CRE군 순으로 활성산소의 감소율이 가장 높았으며, 특히 CPE 혼합물은 정상군과 유사한 수준으로 감소하는 경향을 보였다(Fig. 3).
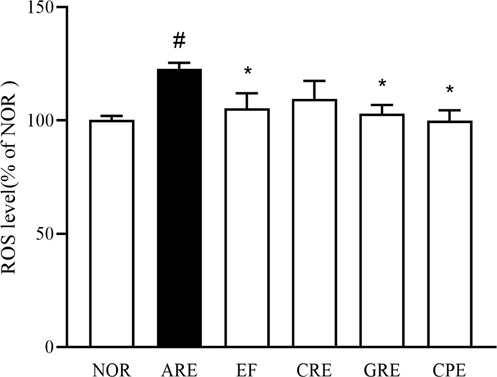
Effect of extract mixture on oxidative stress biomarker levels in the serum in rats reflux esophagitis. All values are mean ± SD (n=5). Data are expressed as means ± SEM, n=5. Significance: #p < 0.05 vs. Normal group, *p < 0.05vs. Control group.
혈청 내 염증성 사이토카인 측정 결과 – 염증성 사이토카인인 TNF-a와 IL-6의 발현은 ROS에 의해 직접적으로 조절될 수 있다. 실험 결과, 정상군에서 TNF-α는 1359.1 ± 144.9 pg/mL였으며, ARE군에서 2048.3 ± 85.0 (p<0.01)로 1.5배 증가하였다. EF군은 1731.4 ± 237.4, CRE군은 1747.7 ± 136.7 (p<0.01), GRE군은 1722.0 ± 174.6, CPE군은 1497.8 ± 97.6 (p<0.05)로 모두 유의미한 감소가 나타났으며, 특히 CPE군에서 26.9% 감소하였다.
IL-6는 정상군에서 171.9 ± 19.8 pg/mL로 나타났으며, ARE군에서 366.7 ± 33.7 (p<0.01)로 2.1배로 증가하였다. EF군은 239.5 ± 50.5 (p<0.05), CRE군은 210.2 ± 26.4 (p<0.01), GRE군은 189.1 ± 33.5 (p<0.01), CPE군은 164.3 ± 37.5 (p<0.01)로 모두 유의미한 감소를 보였으며, ARE군 대비 CPE군에서 가장 큰 감소율을 나타냈다. 즉, 혈청 내 염증성 사이토카인을 CPE > GRE > CRE 순으로 유의적인 감소를 나타냈다(Fig. 4).
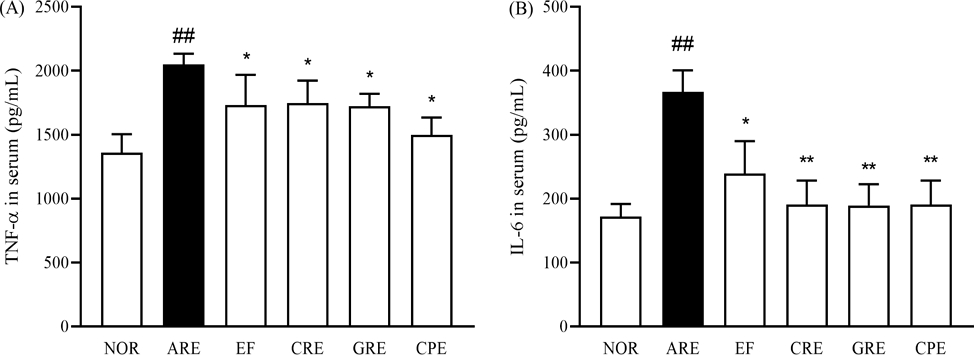
Effect of extract mixtures on serum levels of tumor necrosis factor (TNF)-α, interleukin (IL)-1 of rats with reflux esophagitis. (A) TNF-α (B) IL-1. All values are mean ± SD (n=5). Data are expressed as means ± SEM, n=5. Significance: ##p < 0.01 vs. Normal group, *p < 0.05, **p < 0.01 vs. Control group.
Malondialdehyde (MDA) 측정 결과 – 세포 내 철분 농도가 증가하면 ROS가 생성되고, 이로 인해 지방산 산화가 촉진되고 최종 생성물인 MDA가 생성된다. 이 MDA는 산화스트레스의 지표로서 주로 지방산의 산화에 의해 생성되는 화합물이고, cytokine은 면역 반응을 조절하여 면역 세포들 간의 상호작용을 통해 염증과 면역 반응을 조절한다.22) 본 실험에서 혈청과 조직에서 MDA를 측정한 결과, 혈청에서 정상군 대비 ARE군에서 1.6배 증가하였으며, EF군은 29.0% (p<0.05), CRE군은 18.2% (p<0.05), GRE군은 18.5% (p<0.05), CPE군은 31.5% (p<0.01)으로 나타났으며, CPE군에서 가장 유의적인 감소를 나타냈다. 또한, 조직에서 MDA를 측정한 결과, 정상군 대비 ARE군에서 2.7배 증가하였으며, EF군은 21.0% (p<0.01), CRE군은 29.8% (p<0.001), GRE군은 21.5% (p<0.01), CPE군은 33.5% (p<0.001)으로 나타났으며, CRE군과 CPE군에서 가장 유의적인 감소를 나타냈다(Fig. 5).
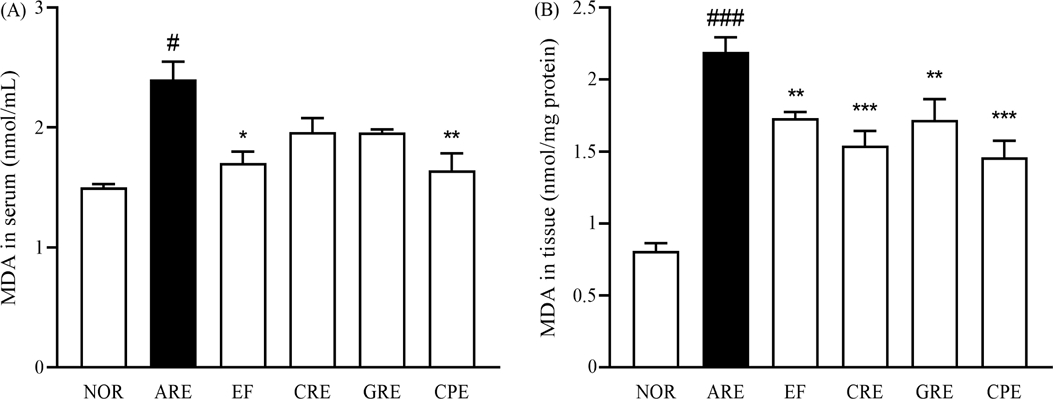
Effect of extract mixtures on serum levels of Malondialdehyde (MDA) of rats with reflux esophagitis. (A) MDA in the serum (B) MDA in the tissue. All values are mean ± SD (n=5). Data are expressed as means ± SEM, n=5. Significance: #p < 0.05, ###p < 0.001 vs. Normal group, *p < 0.05, **p < 0.01 vs, ***p < 0.01 vs. Control group.
식도 조직 내 단백질 발현량 측정 결과
NF-κB p65 발현량 분석 – NF-κB p65는 식도 상피세포에서 염증 반응 조절, 면역 체계 조절 및 세포 증식에 관여하는 단백질로, TNF-α가 세포에 결합하면 NF-κB p65신호 전달 경로가 활성화되어 세포질에서 핵으로 이동한다고 잘 알려져 있다.23) 이와 관련하여 TNF-α 억제제를 이용하여 지속적으로 연구되고 있는 단백질이다.24) 본 실험에서 NF-κB p65의 단백질 발현량을 비교 분석한 결과, 정상군 대비 급성 역류성 식도염을 유발한 ARE군에서 1.9배 증가하였다. 대조군 대비 EF군에서 32.5% (p<0.001), CRE군에서 20.8% (p<0.001), GRE군에서 30.9% (p<0.001), CPE군에서 32.9% (p<0.001)로 유의적으로 감소하는 경향이 나타났다. 각 군을 비교한 결과, CPE > GRE > CRE 순으로 NF-κB p65경로를 유의적으로 억제하여 산화적 스트레스를 억제시킴으로써 식도 점막의 염증을 감소시키는 것으로 판단된다(Fig. 6).

Expression of inflammatory factors (NF-κB p65) in rat esophageal tissue, assessed by Western blot analysis. Data are expressed as means ± SEM, n=5. Significance: ###p < 0.001 vs. Normal group, ***p < 0.001 vs. Control group.
iNOS, COX-2 발현량 분석 – 역류성 식도염에서 식도 점막은 위산이나 담즙에 반복적으로 자극을 받으면서 염증 반응을 일으킵니다. 이 과정에서 염증성 사이토카인들이 방출되어 iNOS의 발현을 증가시키며, 이는 산화질소(NO) 생성의 증가로 이어져 염증을 악화시킵니다. 또한, 위산과 담즙이 식도로 역류하면 COX-2가 유도되어 프로스타글란딘 합성을 증가시킵니다. 이러한 변화들은 식도 점막의 손상을 심화시키고, 장기적으로는 바렛 식도로 진행될 수 있습니다.25) 본 실험에서 iNOS의 단백질 발현량을 비교 분석한 결과, 정상군 대비 급성 역류성 식도염을 유발한 ARE군에서 3.3배 증가하였다. 대조군 대비 EF군에서 50.0% (p<0.01), CRE군에서 4.9%, GRE군에서 49.1% (p<0.01), CPE군에서 54.5% (p<0.01)로 유의적으로 감소하는 경향이 나타났다. 각 군을 비교한 결과, EF 단독 투여한 군과 CPE군에서 감소율이 가장 높게 나타났다.
또한, COX-2의 단백질 발현량을 비교 분석한 결과, 정상군 대비 급성 역류성 식도염을 유발한 ARE군에서 1.5배 증가하였다. ARE군 대비 EF군에서 29.3% (p<0.01), CRE군에서 14.0%, GRE군에서 20.0% (p<0.05), CPE군에서 26.4% (p<0.05)로 유의적으로 감소하는 경향이 나타났다. 각 군을 비교한 결과, EF 단독 투여한 군과 CPE 군에서 감소율이 가장 높게 나타났다(Fig. 7).
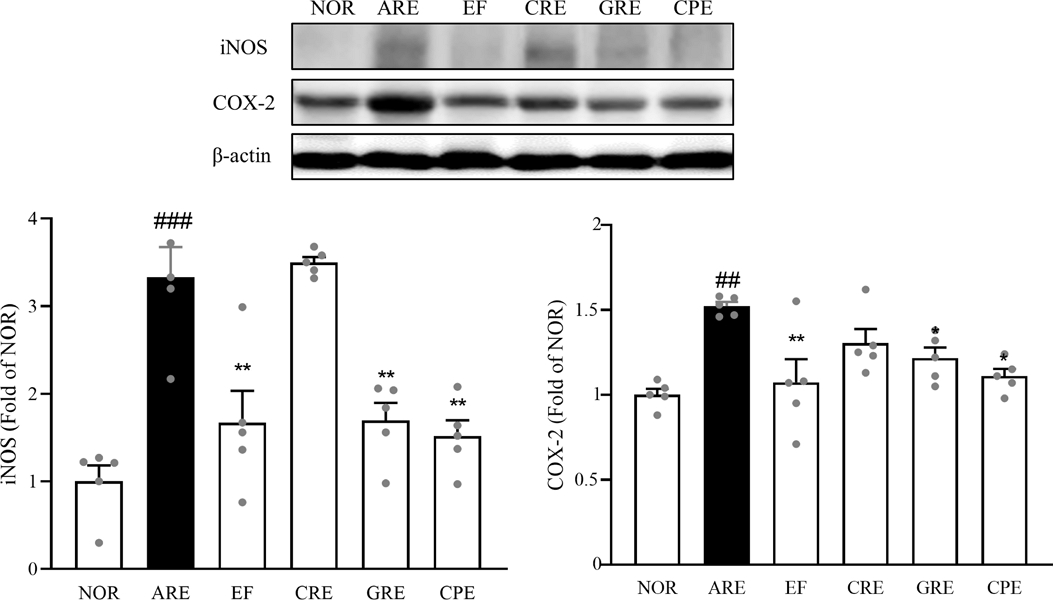
Expression of pro-inflammatory mediators (iNOS and COX-2) in rat esophageal tissue, assessed by Western blot analysis. Data are expressed as means ± SEM, n=5. Significance: ##p < 0.01, ###p < 0.001 vs. Normal group, *p < 0.05, **p < 0.01vs. Control group.
Antioxidant enzymes 발현량 분석 – 식도 조직에서 세포 대사 및 환경적 스트레스로 인해 생성되는 활성산소종(ROS)과 그에 따른 산화적 스트레스의 역할이 중요한 것으로 나타났다.26) 특히, superoxide (O2-)는 주로 미토콘드리아에서 생성되며, 이는 SOD 효소에 의해 과산화수소(H2O2)로 변환되고, 이후 생성된 H2O2는 GPx-1/2 효소에 의해 물과 산소로 분해된다.27) 이러한 과정은 항산화 방어 시스템의 중요한 부분으로, 체내에서 활성화된 항산화 단백질들은 GPx-1/2, SOD, catalase와 같은 주요 항산화 물질들을 합성하여 산화적 스트레스를 감소시킨다.28) 본 실험에서 western blot을 실시하여 항산화 효소(SOD-1, catalase, GPx-1/2, HO-1)를 분석하였다. 정상군 대비 급성 역류성 식도염을 유발한 ARE군에서 SOD-1 (p<0.001), catalase (p<0.01), GPx-1/2 (p<0.01), HO-1 (p<0.01) 모두 유의적인 감소를 나타냈다. 반면, ARE군 대비 모든 군에서 항산화 관련 단백질들이 증가하는 경향을 보였으며, 그 중 GPx-1/2는 정상군 대비 급성 역류성 식도염을 유발한 ARE군 대비 EF투여군은 1.6배, CRE 투여군은 1.7배(p<0.05), GRE 투여군은 2.0배(p<0.01), CPE 투여한 군은 2.3배(p<0.001)로 CPE군에서 가장 많이 증가하는 경향을 나타냈다. 이를 통해 각 추출물이 항산화 효능을 나타내며, 체내 산화스트레스를 완화시킬 수 있을 것으로 보인다. 특히 CPE군이 EF 단독 투여한 군과 비교하여 SOD-1과 GPx-1/2의 단백질 발현량이 유의적인 증가를 나타냈다(Fig. 8).
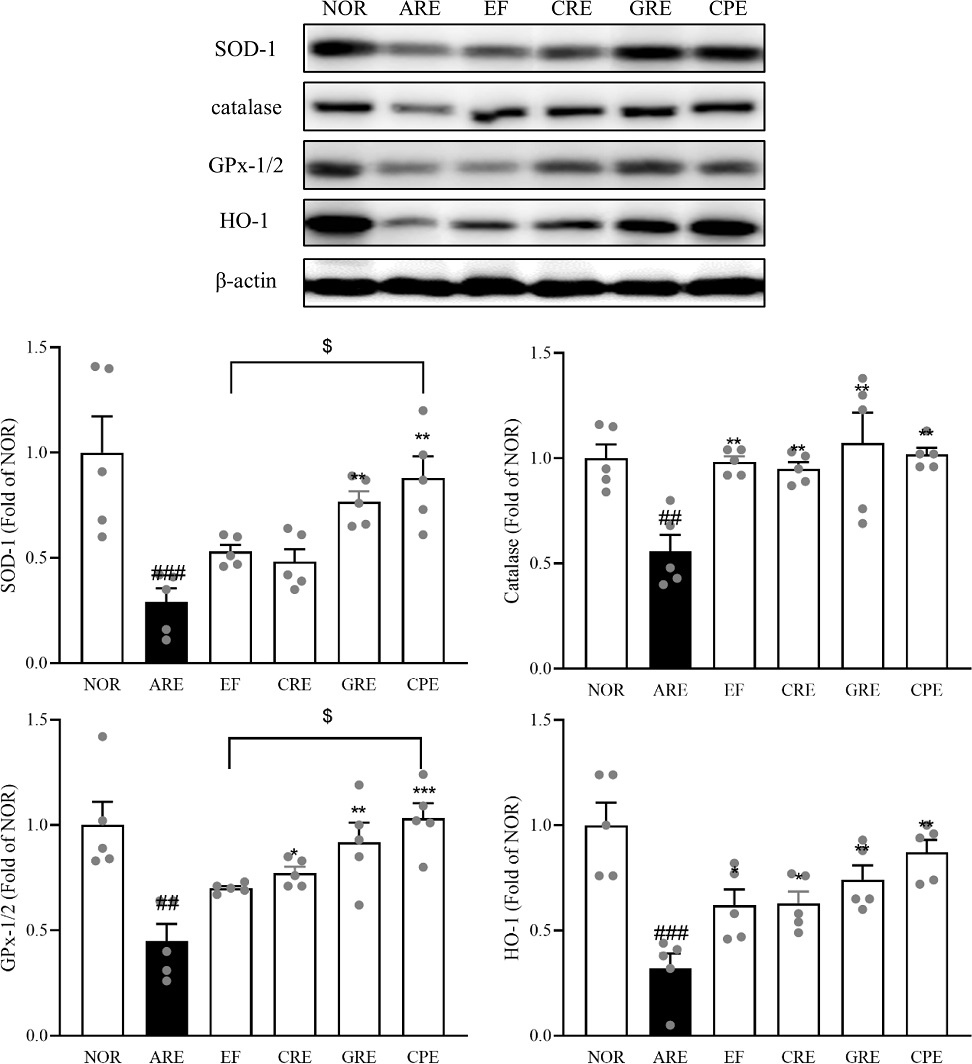
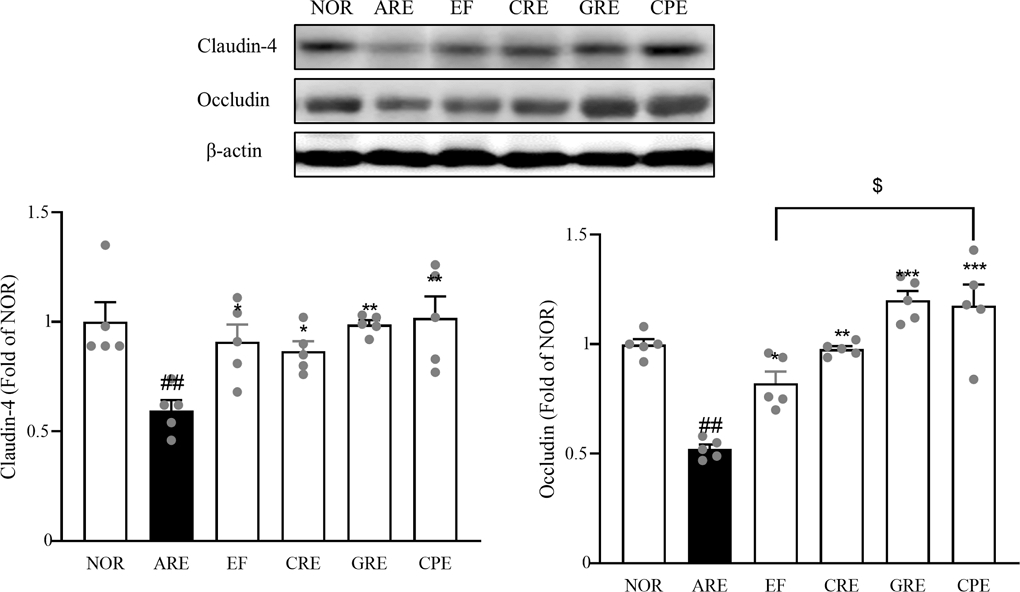
Expression of antioxidant enzymes (SOD-1, catalase, HO-1, and GPX1-2) in rat esophageal tissue, assessed by Western blot analysis. Data are expressed as means ± SEM, n=5. Significance: ##p < 0.01, ###p < 0.001 vs. Normal group, *p < 0.05, **p < 0.01, ***p < 0.01 vs. Control group, $p < 0.05 vs. EF group.
Tight junction 발현량 분석 – 밀착접합 형성에 관여하는 claudin-4는 식도 상피세포의 세포막, 주로 가시상층에 국한되어 있으며, occludin은 모든 식도 점막층의 세포막에서 관찰된다고 알려져 있다. 이들은 tight junction에서 물리적 장벽을 형성하고, 세포간 수송을 조절하는데 필수 적인 역할을 한다.29) 이와 관련하여 역류성 식도염에서 식도 점막이 손상되면 claudin을 포함한 tight junction 단백질의 발현이 감소한다고 알려져 있다.30) 각 추출물과 EF 배합비(1:4)를 투여하여, 역류성 식도염 유발에 의한 식도 상피 장벽의 변화를 확인해 보고자 하였다. Claudin-4을 측정한 결과, 정상군 대비 급성 역류성 식도염을 유발한 ARE군에서 40.9% 감소하였다. ARE군 대비 EF를 투여한 군은 1.5배(p<0.05) 증가하였으며, CRE 투여한 군은 1.5배(p<0.05), GRE 투여한 군은 1.7배(p<0.01), CRE 투여한 군은 1.7배(p<0.01)로 증가 하였다. 또한, occludin을 측정한 결과, 정상군 대비 급성 역류성 식도염을 유발한 ARE군에서 47.6% 감소하였으며, 대조군 대비 EF를 투여한 군은 1.6배(p<0.05) 증가하였으며, CRE 투여한 군은 1.9배(p<0.01), GRE 투여한 군은 2.3배(p<0.001), CRE 투여한 군은 2.2배(p<0.001)로 유의적인 증가를 나타냈다(Fig. 9). 본 실험에서는 각 추출물과 EF와 혼합물 투여가 급성 역류성 식도염을 유발한 동물에서 tight junction 단백질인 claudin-4과 occludin발현이 유의하게 증가시키는 것을 확인하였으며, EF 단독 투여군보다 CPE 투여군이 더욱 증가하였다. 이는 각 혼합물 투여군에서 상피세포 결합 조직을 보호했음을 나타낸다. 이러한 결과는 모든 군에서 상피 세포의 결합력을 개선하고 급성 역류성 식도염으로 인한 손상을 줄이는 데 효과적임을 보여주었으며, 그 중에서도 CPE군에서 더 유의적인 효과가 나타났다(Fig. 9).
결 론
본 연구에서는 in vitro 실험을 통해 오수유와 천궁, 인삼, 진피의 최적 배합비(1:4)를 결정한 후, 오수유에 천궁, 인삼, 진피를 각각 혼합한 복합물(CRE, GRE, CPE)을 사용하여 급성 역류성 식도염을 유발한 동물 모델에서 염증 개선 효과를 평가하였다. 모든 복합물 처리군에서 급성 역류성 식도염 개선 효과를 보였으며, 특히 오수유와 진피 복합물(CPE)이 ROS, 염증성 사이토카인(TNF-α, IL-6), 및 지질과산화 억제에서 가장 우수한 효과를 나타냈다. CPE군은 오수유 단독 투여군(EF)과 비교했을 때, 항산화 효소인 SOD-1과 GPx-1/2의 발현에서 유의미한 증가를 보였으며, tight junction 단백질인 occludin의 발현 또한 유의하게 증가하였다. 이를 통해 CPE는 EF 단독 처리보다 급성 역류성 식도염 치료에 더욱 유망한 후보 물질로 평가될 수 있으며, 이러한 효과는 항산화 효소 활성 증진과 tight junction 강화에 기인한 것으로 판단된다.
다만, 본 복합물이 임상에 적용되기 위해서는 추가적인 심층 연구가 필요할 것으로 사료된다.
Acknowledgments
이 논문은 한국 정부(MSIT)의 지원을 받은 한국연구재단(NRF) 보조금(번호: 2022R1A2B5B01002571)과 한국 정부(MSIP)가 지원하는 기초과학연구프로그램(번호: 2018R1A5A2025272)을 통해 지원받았다.
References
-
Hunt, R. H. (1999) Importance of pH control in the management of GERD. Arch. Intern. Med. 159: 649-657.
[https://doi.org/10.1001/archinte.159.7.649]

-
Souza, R. F., Krishnan, K. and Spechler, S. J. (2008) Acid, bile, and CDX: the ABCs of making Barrett's metaplasia. Am. J. Physiol. Gastrointest. Liver Physiol. 295: G211-218.
[https://doi.org/10.1152/ajpgi.90250.2008]

-
Maev, I. V., Livzan, M. A., Mozgovoi, S. I., Gaus, O.V. and Bordin, D. S. (2023) Esophageal mucosal resistance in reflux esophagitis: What we have learned so far and what remains to be learned. Diagnostics 13: 2664.
[https://doi.org/10.3390/diagnostics13162664]

- Lee, J. A., Shin, M. R., Lee, S. N., Park, S. A. and Park, H. J. (2020) Effect of a mixture of Rhei Rhizoma and Scutellariae Radix extract on acute reflux esophagitis rats. Kor. J. Herbol. 35: 43-53.
-
Niv, Y. and Fass, R. (2011) The role of mucin in GERD and its complications. Nat. Rev. Gastroenterol Hepatol. 9: 55-59.
[https://doi.org/10.1038/nrgastro.2011.211]

- Nam, H. H., Seo, Y. S., Song, J. H., Lee, A. Y., Noh, P. R. and Moon, B. C. (2022) Crab water extract ameliorates reflux esophagitis in rats. Herbal Formula Science 30: 11-18.
- Candelli, M., Carloni, E., Armuzzi, A., Cammarota, G., Ojetti, V., Pignataro, G., Santoliquido, A., Pola, R., Pola, E., Gasbarrini, G. and Gasbarrini A. (2000) Role of sucralfate in gastrointestinal diseases. Panminerva Med. 42: 55-59.
-
Pellati, F., Benvenuti, S., Yoshizaki, F., Bertelli, D. and Rossi, M. C. (2005) Headspace solid-phase microextraction-gas chromatography--mass spectrometry analysis of the volatile compounds of Evodia species fruits. J. Chromatogr. A 1087: 265-273.
[https://doi.org/10.1016/j.chroma.2005.01.060]

-
Choi, Y. H., Shin, E. M., Kim, Y. S., Cai, X. F., Lee, J. J. and Kim, H. P. (2006) Anti-inflammatory principles from the fruits of Evodia rutaecarpa and their cellular action mechanisms. Arch. Pharm. Res. 29: 293-297.
[https://doi.org/10.1007/BF02968573]

- Lee, J. A., Park, H. J., Lim, S. H., Kim, M. J., Kim, K. J., Shin M. R. and Roh, S. S. (2019) Evaluation of Evodiae Fructus extract on the chronic acid reflux esophagitis in rats. The Korea Jounrnal of Herbology 34: 15-23.
-
Kim, D. J. and Roh, S. S. (2012) Effect on acute reflux esophagitis by Evodiae Fructus aquous extract. The Korea Jounrnal of Herbology 27: 51-58
[https://doi.org/10.6116/kjh.2012.27.1.51]

- Jeong, I. H., Kim, M. J., Shin, M. R. and Roh, S. S. (2024) Screening for mucosal protective effects of various Korean herbal medicine extracts in gastroesophageal reflux disease. The Korea Jounrnal of Herbology 39: 39-47.
-
Singleton, V. and Rossi, J. (1965) Colorimetry of total phenolic compounds with phosphomolybdic-phosphotungstic acid reagents. Am. J. Enol. Vitic. 16: 144-158.
[https://doi.org/10.5344/ajev.1965.16.3.144]

-
Woisky, R. and Salatino, A. (1998) Analysis of propolis: Some parameters and procedures for chemical quality control. J. Apic. Res. 37: 99-105.
[https://doi.org/10.1080/00218839.1998.11100961]

-
Blois M. (1958) Antioxidant determinations by the use of a stable free radical. Nature 181: 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Re, R., Pellegrini, N., Proteggente, A., Pannala, A., Yang, M. and Rice-Evans, C. (1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic. Biol. Med. 26: 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Mihara, M. and Uchiyama, M. (1978) Determination of malonaldehyde precursor in tissues by thiobarbituri acid test. Anal. Biochem. 86: 271-278.
[https://doi.org/10.1016/0003-2697(78)90342-1]

-
Yoshida, N. (2007) Inflammation and oxidative stress in gastroesophageal reflux disease. J. Clin. Biochem. Nutr. 40: 13-23.
[https://doi.org/10.3164/jcbn.40.13]

-
Shimada, K. K., Fujikawa, K. Y. and Nakamura, T. (1992) Antioxidative properties of xanthan on autoxidation of soybean oil in cyclodextrin. J. Agric. Food. Chem. 40: 945-948.
[https://doi.org/10.1021/jf00018a005]

-
Kim, S. H., Shin, M. R., Lee, A. R., Seo, B. I., Park, H. J. and Roh, S. S. (2020) Improvement of inflammation through antioxidant pathway of Gardeniae Fructus 50% EtOH extract (GE) from acute reflux esophagitis rats. Biomed. Res. Int. 12: 4826176.
[https://doi.org/10.1155/2020/4826176]

-
Valkonen, M. and Kuusi, T. (1997). Spectrophotometric assay for total peroxyl radical-trapping antioxidant potential in human serum. J. Lipid Res. 38: 823-833.
[https://doi.org/10.1016/S0022-2275(20)37249-7]

-
Oh, T. Y., Lee, J. S., Ahn, B. O. Cho, H., Kim, W. B., Kim, Y. B., Surh, Y. J., Cho, S., W., Lee, K. M. and Hahm, K. B. (2001) Oxidative stress is more important than acid in the pathogenesis of reflux oesophagitis in rats. Gut 49: 364-371.
[https://doi.org/10.1136/gut.49.3.364]

-
Chen, H., Fang, Y., Li, W., Orlando, R. C., Shaheen, N. and Chen, X. L. (2013) NFκB and Nrf2 in esophageal epithelial barrier function. Tissue Barriers 1: e27463.
[https://doi.org/10.4161/tisb.27463]

-
Choo, B. K. and Roh, S. S. (2013) Berberine protects against esophageal mucosal damage in reflux esophagitis by suppressing proinflammatory cytokines. Exp. Ther. Med. 6: 663-670.
[https://doi.org/10.3892/etm.2013.1202]

-
Ferguson, H. R., Wild, C. P., Anderson, L. A., Murphy, S. J., Johnston, B. T., Murray, L. J., Watson, R. G., McGuigan, J., Reynolds, J. V. and Hardie, L. J. (2008) Cyclooxygenase-2 and inducible nitric oxide synthase gene polymorphisms and risk of reflux esophagitis, Barrett's esophagus, and esophageal adenocarcinoma. Cancer Epidemiol. Biomarkers Prev. 17: 727-731.
[https://doi.org/10.1158/1055-9965.EPI-07-2570]

-
Kim, M. J., Bae, N. Y., Kim, K. B. W. R., Park, S. H., Jang, M. R. and Ahn, D. H. (2016) Anti-inflammatory activity of ethanol extract of Sargassum miyabei Yendo via Inhibition of NF-κB and MAPK Activation. Microbiol. Biotechnol. Lett. 44: 442–451.
[https://doi.org/10.4014/mbl.1607.07001]

-
Lee, J. S., Oh, T. Y., Ahn, B. O., Cho, H., Kim, W. B., Kim, Y. B., Surh, Y. J., Kim, H. J. and Hahm, K. B. (2001) Involvement of oxidative stress in experimentally induced reflux esophagitis and Barrett's esophagus: clue for the chemoprevention of esophageal carcinoma by antioxidants. Mutat. Res. 480-481.
[https://doi.org/10.1016/S0027-5107(01)00199-3]

-
Wetscher, G. J., Hinder, P. R., Bagchi, D., Perdikis, G., Redmond, E. J., Glaser, K., Adrian, T. E. and Hinder, R. A. (1995) Free radical scavengers prevent reflux esophagitis in rats. Dig. Dis. Sci. 40: 1292-1296.
[https://doi.org/10.1007/BF02065541]

-
Nam, H. H., Nan, L. and Choo, B. K. (2018) Dichloromethane extracts of Geranium koreanum Kom. Alleviates esophagus damage in acute reflux esophagitis-induced rats by anti-inflammatory activities. Int. J. Mol. Sci. 19: 3622.
[https://doi.org/10.3390/ijms19113622]

-
Asaoka, D., Miwa, H., Hirai, S., Ohkawa, A., Kurosawa, A., Kawabe, M., Hojo, M., Nagahara, A., Minoo, T., Ohkura, R., Ohkusa, T. and Sato, N. (2005) Altered localization and expression of tight-junction proteins in a rat model with chronic acid reflux esophagitis. J. Gastroenterol. 40: 781-790.
[https://doi.org/10.1007/s00535-005-1628-6]